
14.下列说法中,正确的是 ( )
A.所有主族元素正化合价数,等于它的族序数
B.VII A族元素的原子随核电荷数的增加,得电子能力逐渐减弱
C.IA、IIA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
D.前三周期元素中共有非金属元素12种
13.已知某酸H2B在水溶液中存在下列关系:
①H2B
 H++HB-,②HB-
H++HB-,②HB-  H++B2-。关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是 ( )
H++B2-。关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是 ( )
A.NaHB属于弱电解质
B.溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-)
C.c(Na+)=c(HB-)+c(B2-)+c(H2B)
D.NaHB和NaOH溶液反应的离子方程式为H++OH- H2O
12.下列叙述中,正确的是 ( )
A.金刚石是碳的一种同位素
B.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
C.离子化合物均属于强电解质,都易溶于水
D.离子键、共价键都属于静电作用
11.下列说法中,不正确的是 ( )
A.形成化学键吸收能量,破坏化学键释放能量
B.14g乙烯和丙烯的混合物中原子的物质的量为3 mol
C.向豆浆中加入硫酸钙溶液会产生聚沉现象
D.H+、NO3-、Fe2+、Na+在溶液中不能大量共存
9.化学与科技、社会、生产密切结合。下列说法中,不正确的是 ( )
A.推广使用“乙醇汽油”,有利于节能减排
B.使用“无磷洗涤剂”,能有效减少水体富营养化的发生
C.“无氟冰箱”的使用,有利于臭氧层的保护
D.向海水中加入净水剂明矾可以使海水淡化
|
|
A.丙烷既能发生取代反应,又能发生加成反应
B.丙烷完全燃烧,其产物对空气没有污染
C.丙烷燃料电池中,丙烷在正极发生反应
D.丙烷的一氯取代物有三种同分异构体
33.(8分)据《中国制药》报道,化合物C是用于合成某药品的中间体,其合成路线为:
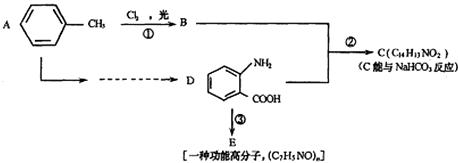
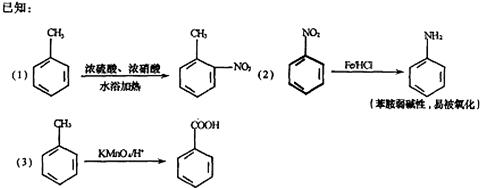
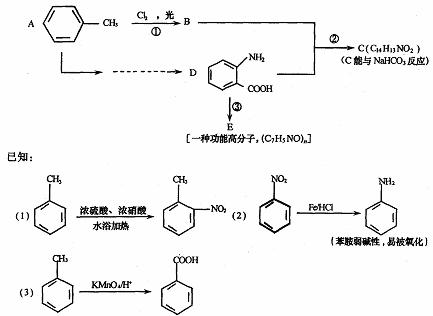
回答下列问题:
(1)写出下列物质的结构简式:C ,E 。
(2)A→D的转化中,接反应的先后顺序,写出所涉及反应的反应类型 。
(3)物质F与D互为同分异构体,其苯环上有两个取代基,FeC13溶液不能使其变色。则符合上述条件的F的结构有 种。
32.(8分)
(1)水分子的立体结构是 ,水分子能与很多金属离子形成配合物,其原因是在氧原子上有 。
(2)冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如右图,其中空心所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似。每个冰晶胞平均占有 个水分子。冰晶胞与金刚石晶胞微粒排列方式相同的原因是 。
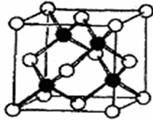
(3)实验测得冰中氢键的作用能为18.5kJ·mol-1,而冰熔化热为5.0kJ·mol-1,这说明 。
[化学--有机化学基础]
31.(8分)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺,请按要求回答问题:
(1)“氨碱法”产生大量CaC12废弃物,请写出该工艺中产生CaC12的化学方程式:
;
(2)写出“联合制碱法”有关反应的化验学方程式:
; 。
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?
;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:
原子利用率(%)= 。
[化学--物质结构与性质]
29. (14分)已知反应:N2(g)+3H2(g) 2NH3(g)
(14分)已知反应:N2(g)+3H2(g) 2NH3(g) 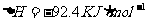 。
。
(1)在一定条件下,向一密闭容器中充入1molN2和3molH2,充分反应后放出的热量
(填“<”“>”“=”)92.4KJ,理由是 。
(2)在500℃、200atm和铁催化条件下,将H2和N2通入固定容积为1L的恒温密闭容器中发生反应,反应过程中H2、N2和NH3物质的
量变化如图所示,根据题完成下列各问:
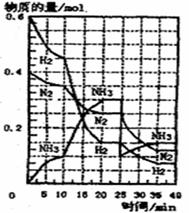
①反应达到平衡时,平衡常数K= ,此时增加N2的量,平衡常数将 。
②反应进行到20min时,N2的平均反应速率为 。
③据图判断,反应进行到10min至20min时曲线发生变化的原因是 ;
反应进行至25min时,曲线发生变化的原顺是 。
(3)①若在上述(2)条件下,向容器中通入a molN2与b molH2的混合气体,当反应达到平衡时,测得n(N2)=c mol,n(NH3)=d mol,则a= (用含其它字母的关系式表示)。
②若在上述相同温度和催化剂的条件下,向一个初始容积仍为1L的,但容积可变、能保持恒压(200 atm)的密闭容器中通入a mol N2与b mol H2的混合气体,反应达平衡时生成NH3 e mol,则d与e比较 (填编号)
A.d<e B.d>e C.d=e D.不能比较
作出此判断的理由是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com