
6.下列现象不是因为发生化学变化而产生的是 ( )
A.皮肤不慎沾上浓硝酸而呈黄色
B.久置的KI溶液呈黄色
C.盛在无色试剂瓶中的浓硝酸呈黄色
D.食盐撒在燃着的液化气的火焰上,火焰呈黄色
33.(8分)[化学-有机化学基础]
下图是以C7H8为原料合成某聚酰胺类物质(C7H5NO)n的流程图。
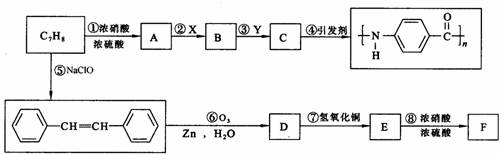
已知:(Ⅰ)当苯环上已经有了一个取代基时,新引进的取代基因受原取代基的影响而取代其邻、对位或间位的氢原子。使新取代基进入它的邻、对位的取代基有-CH3、-NH2等;使新取代基进入它的间位的取代基有-COOH、NO2等;
(Ⅱ)R-CH=CH-R′ R-CHO+R′-CHO
R-CHO+R′-CHO
(Ⅲ)氨基(-NH2)易被氧化;硝基(-NO2)可被Fe和盐酸还原成氨基(-NH2)
回答下列问题:
(1)X、Y各是下列选项中的某一项,其中x是 。(填写序号)
A.Fe和盐酸 B.酸性KMnO4溶液 C.NaOH溶液
(2)已知B和F互为同分异构体,写出物质F的结构简式 。
(3)分别写出D、E中的含氧官能团的名称 ; 。
(4)对物质C的下列说法中,正确的是 (填写序号)。
A.能发生酯化反应
B.能与溴水发生加成反应
C.只能和碱反应不能和酸反应
(5)写出反应⑦的化学方程式,并注明反应类型。
;
。
32.(8分)[化学-物质结构与性质]
原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F-少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:
|
化合物 |
甲 |
乙 |
|
原子个数比 |
B:A=1:4 |
C:A=1:3 |
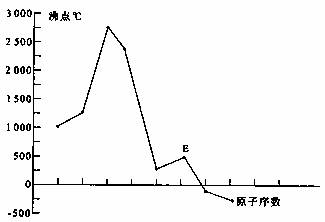
(1)元素E的基态原子的电子排布式为 。
(2)写出化合物乙的结构式 ,该分子中C的原子轨道发生的是 杂化。
(3)B、C形成的一种化合物X是一种原子晶体,晶体中B、C原子均达到8电子稳定结构,则x的化学式为 。
(4)D在F中燃烧的产物属于 晶体,其晶体中与D+最近且等距离的F-有
个。
31.(8分)[化学-化学与技术]
硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有 (任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填写序号)。
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.转化器中使用适宜的温度 D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
2SO2(g)+O2(g) 2SO3(g) △H=-98.3kJ·mol-1
2SO3(g) △H=-98.3kJ·mol-1
在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为 。
(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的。
。
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
。
30.(16分)某校化学兴趣小组学习草酸的性质后,查阅资料获得了草酸的一些信息:
(Ⅰ)草酸晶体(H2C2O4·2H2O)加热至100.1℃时失去结晶水,成为无水草酸;
(Ⅱ)无水草酸大约在157℃升华,175℃以上发生分解:
HOOC-COOH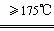 CO2↑+CO↑+H2O↑
CO2↑+CO↑+H2O↑
(Ⅲ)H2C2O4可以和碱反应生成相应的盐:H2C2O4+Ba(OH)2 BaC2O4↓+2H2O
该小组采用下图所示的实验装置,通过实验验证无水草酸受热分解的产物,并利用反应产生的纯净CO气体来还原铁的某种氧化物(FezOy),以确定FexOy的组成。

请回答下列问题:
(1)实验所需的仪器如上图所示,各仪吕的连接顺序为:c接 、 接 、 接 。
(2)该组同学进行了下列实验操作:
①点燃B处左侧的酒精灯;
②检验实验装置的气密性;
③反应结束后,熄灭酒精灯;
④点燃C处的酒精灯,开始反应,并对装置B的d口处气体进行验纯,点燃尖嘴d处的酒精灯。
⑤向实验装置中装入药品
(3)D装置中澄清石灰水的作用 ,B装置中澄清石灰水的作用
。
(4)B装置中d处酒精灯的作用是
。
(5)已知硬质玻璃管的质量为45.00g,反应前加入14.80gFexOy样品;反应后硬质玻璃管与剩余固体的总质量为53.40g,计算样品FexOy中x:y= 。
(6)该小组设计了实验 (填“有”或“无”)不妥之处。如有不妥,请说出不妥的原因
。
[选做部分]
|
|
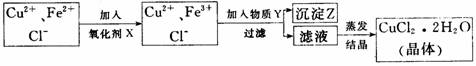
29.(15分)氯化铜晶体中常含FeC1杂质,为制得纯净氯化铜晶体(CuC12·2H2O),首先将其溶于稀盐酸中,然后按下面所示操作步骤进行提纯。
已知:
|
|
氢氧化物开始沉淀时的pH |
氯氧化物沉淀完全时的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Cu2+ |
4.7 |
6.7 |
(1)下列物质中,最适合作为氧化剂X的是 (填序号)
A.H2O2 B.KMnO4 C.NaC1O D.浓硫酸
写出加入X后发生反应离子的方程式 。
(2)加入的物质Y可以是 ,目的是
。
(3)某同学利用反应Cu+2H+ Cu2++H2↑设计实验来制取氯化铜溶液。该同学设计的装置应该为
。(填“原电池”或“电解池”)。请在右侧方框中画出该同学设计的装置图,并指明电极材料和电解质溶液。
Cu2++H2↑设计实验来制取氯化铜溶液。该同学设计的装置应该为
。(填“原电池”或“电解池”)。请在右侧方框中画出该同学设计的装置图,并指明电极材料和电解质溶液。

(4)从CuC12稀溶液中得到CuC12·2H2O晶体,在蒸发结晶的过程中,为了防止Cu2+的水解,应采取的措施是 。
28.(11分)二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中 能导致酸雨的形成;目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。
如:CO(g)+NO2(g) NO(g)+CO2(g) △H=-akJ·mol-1(a>0)
2CO(g)+2NO2(g) N2(g)+2CO2(g) △H=-bkJ·mol-1(b>0)
据此回答:若用标准状况下3.36升CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
(2)在火力发电厂产生的废气中含有SO2、N2、CO等气体,为除去SO2,常用
Ca(OH)2悬浊液洗涤废气,为了废物利用,再通入空气使反应产物转化为石膏(CaSO4·2H2O)。写出有关的化学反应方程式 。
(3)硫酸工业生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)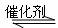 2SO2(g)
2SO2(g)
△H=-196.kJ·mol-1某温度下达到平衡时,SO2的体积百分含量与体系的总压强的关系如右图所示:据此图回答下列问题:
①平衡状态由A变到B时,反应体系 (填“吸收”或“释放”)能量。
②将5molSO2和7molO2通入10L密闭容器中,平衡时体系的总压强为0.1MPa。该反应在该温度下的平衡常数等于 。
2. 第Ⅱ卷所有题目的答案考生须用黑色0.5mm的墨水签字笔答在答题纸上,在试题卷上答题无效。
[必做部分]
1. 第Ⅱ卷共16个题。其中23-30题为必做部分,31-38题为选做部分。考生必须从选做题中选择2个物理题、1个化学题和1个生物题作答。不按规定选做者,阅卷时将根据所选科目题号的先后顺序只判前面的2个物理题、1个化学题和1个生物题。其他作答的题目答案无效。
15.为测定人体血液中Ca2+的含量,设计了如下方案:

有关反应的化学方程式为:
2KMnO4+5H2C2O4+3H2SO4 K2SO4+2MnSO4+10CO2↑+8H2O若血液样品为15mL,滴定生成的草酸消耗0.001mol·L-1的KMnO4溶液15.0mL,则这种血液样品中的含钙量为 ( )
A.0.001mol·L-1 B.0.0025mol·L-1
C.0.0003mol·L-1 D.0.0035mol·L-1
第Ⅱ卷(必做120分+选做32分,共152分)
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com