
21.A.[物质结构与性质](12分)
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 。
(2)配合物
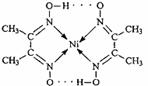
 分子内的作用力有
(填编号)。
分子内的作用力有
(填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如 ①CH2=CH2、②CH≡CH、③

 、④HCHO等,其中碳原子采取sp2杂化的分子有 (填物质序号),预测HCHO分子的立体结构为 形。
、④HCHO等,其中碳原子采取sp2杂化的分子有 (填物质序号),预测HCHO分子的立体结构为 形。
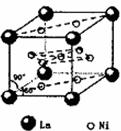
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如下图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为 。
20.(7分)为测定某工厂排放的污水中苯酚的含量,进行如下实验:取污水试样10.00mL加水释释至100mL,加入10.0mL一定浓度的KBrO3和KBr的混合溶液,立即加入5mL盐酸,摇匀后加入1gKI固体(足量),再摇匀,放置5min。用0.01000mol/Lna2S2O3标准溶液滴定至淡黄色,加入1mL淀粉溶液,继续滴定至蓝色刚好褪去,用去Na2S2O3标准溶液14.46mL。同时以水代替污水试样做对比实验,用去Na2S2O3标准溶液38.46mL。
(1)已知上述实验中发生的反应有: KBrO3+5KBr+6HCl=3Br2+3H2O+6KCl
2Na2S2O3+I2=Na2S4O6+2NaI
请写出实验中还涉及的另两个反应的化学方程式: 、 。
(2)试计算此污水中苯酚的含量(以mg/L表示,苯酚的相对分子质量为94.00)。
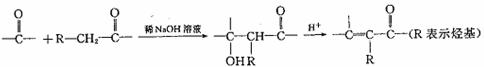
19.(13分)已知:
I.在一定条件下,一些含羰基的化合物能发生如下反应:
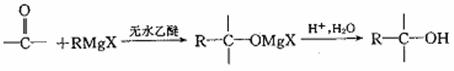
II.格氏试剂(RMgX,X表示卤原子)与含羰基的化合物能发生如下反应:
(1)以柠檬醛为原料,按以下反应流程图合成维生素A:
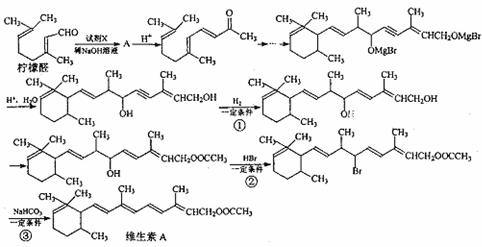
上述流程中,试剂X的结构简式为 ,①、②、③的反应类型分别是 、
、 。
(2)利用题目所给信息和学过的反应原理,以
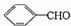
 、CH3CHO和CH3MgBr为有机原料(其他无机试剂任选),可以分5步合成
、CH3CHO和CH3MgBr为有机原料(其他无机试剂任选),可以分5步合成
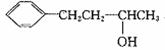
 ,用反应流程图表示
。
,用反应流程图表示
。
(3)
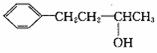
 有多种同分异构体,其中属于酚类且苯环上只有两个对位基的同分异构体共有 种。
有多种同分异构体,其中属于酚类且苯环上只有两个对位基的同分异构体共有 种。
18.(10分)二氧化氯(ClO2)被称作第四代杀菌消毒剂。
(1)工业上用NaCl还原NaClO3生产ClO2的工艺流程如下图所示:
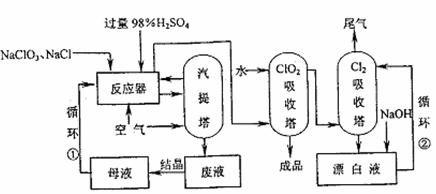
①反应器中发生反应的化学方程式为:
2NaClO3+2NaCl+2H2SO4=2ClO2↑+Cl2↑+2Na2SO4+2H2O
生产中将NaClO3和NaCl按物质的量之比1:1.05的混合水溶液加入反应器,NaCl稍过量的目的是 。
②反应器中生成的ClO2和Cl2由通入空气驱出进入ClO2吸收塔,产生的混合液进入汽提塔,汽提塔排出的废液成分主要是 (填化学式,下同)。
③以上生产流程中循环②循环利用的物质是 。
④为提高ClO2的产量,可用亚氯酸钠(NaClO2)与反应器中Cl2反应生成ClO2,该反应的化学方程式为 。尾气中的Cl2可用SO2水溶液吸收,该反应的化学方程式为 。
(2)用阳离子交换膜分隔的电解池电解450g/L NaClO2溶液,可在阳极室产生ClO2,在阴极室产生H2和NaOH。下列有关说法正确的是 (填字母符号)。
A.电解时电子流向为:电源负极→导线→阴极,阳极→导线→电源正极
B.在电解过程中,Na+向阳极移动,ClO-2向阴极移动
C.在电解过程中阳极周围的pH基本不变
D.电解的离子方程式可表示为:2ClO-2+2H2O  2ClO2↑+H2↑+2OH-
2ClO2↑+H2↑+2OH-
17.(12分)
(1)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
(2)在一定条件下进行如下反应: aX(g)+bY(g)  cZ(g)下图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强关系示意图。
cZ(g)下图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强关系示意图。
①写出该反应的化学平衡常数表达式:K= 。
随着温度的升高,K值 (填“增大”、“减少”、
或“不变”)。当反应物起始浓度相同时,平衡常数K值越大,表明 (填序号)
A.X的转化率越高 B.反应进行得越完全
C.达到平衡时X的浓度越大 D.化学反应速率越快
②如下图所示,相同温度下,在甲、乙两容器中各投入1molX、2molY和适量催化剂,甲、乙两容器的初始体积均为1L。甲、乙容器达到平衡所用时间:甲 乙(填“>”、“<”或“=”,下同),平衡时X和Y的转化率:甲 乙。
16.(8分)甲、乙为单质,丙、丁为化合物,它们之间存在如下图所示的转化关系。
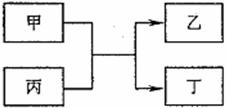
(1)若甲、乙均为非金属,丙为氧化物,则:
①乙为氧化产物时,乙可能是 (填一种物质的化学式),按照元素周期表推测,此时反应物甲可能是 (填一种物质的化学式);②乙为还原产物时,丁所属的物质类别是 。
(2)若该转化关系为我国古代湿法冶炼金属乙的原理,写出此反应的化学方程式 。若该转化关系为高温火法冶炼金属乙的原理,且同时生成的丁是一种有刺激性气味的气体,则丙可能为 (填一种物质的化学式)。
15.(10分)某研究性学习小组在用CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。为控究X的组成,他们进行了如下实验。
I.定性检验
|
实验编号 |
实验操作 |
实验现象 |
|
① |
取少量黑色粉末X放入试管1中,注入浓盐酸,微热 |
黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
|
② |
向试管1中滴加几滴KSCN溶液,振荡 |
溶液出现血红色 |
|
③ |
另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 |
有极少量红色物质析出,仍有较多黑色固体未溶解 |
(1)实验②的目的是 。
(2)由上述实验现象推断,黑色粉末X的成分是 (填化学式)。
II.定量测定
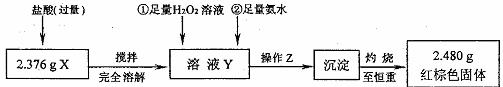
(1)操作Z是 。下列仪器中,在灼烧沉淀时必须用到的是 (填名称)。

(2)写出溶液Y中滴加H2O2溶液是发生反应的离子方程式 。
(3)通过以上数据,得出2.376g黑色粉末X中各成分的物质的量为 。
14.今有一混合物的水溶液,含有以下离子中的若干种:Na+、NH+4、Cl-、Ba2+、HCO-3、SO2-4,现取三份100mL该溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液,加热,收集到标准状况下的气体448mL
(3)第三份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,下列推测正确的是 ( )
A.Na+一定存在 B.100mL该溶液中含0.1mol HCO-3
C.Ba2+一定存在 D.Cl-一定不存在
第Ⅱ卷(非选择题,共72分)
|
13.下列说法错误的是 ( )
A.酸性溶液中K+、Fe3+、I-、SO2-4可以大量共存
B.同体积、同物质的量浓度的NaOH溶液和CH3COOH溶液混合,所得溶液中:
c(Na+)+c(H+)=c(Ac-)+c(OH-)
C.pH=3的Na2SO4和盐酸的混合溶液中:c(Na+)=2c(SO2-4)
D.在0.1mol/L的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
12.铜板上铁铆钉处的腐蚀原理如下图所示,下列有关说法中,错误的是 ( )
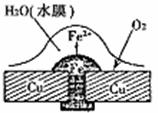
A.正极电极反应式为:2H++2e-=H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铁先被腐蚀
D.此过程中电子由铜板向铁
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com