
6.用铂电极电解CuSO4溶液,当铜离子浓度降至一半时,停止通电,若使CuSO4溶液恢复原浓度,应加入的适量适当物质是 ( )
A.CuSO4 B.CuSO4·5H2O C.CuO D.Cu(OH)2
5.用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是( )
A.NaOH溶液 B.HCl溶液 C.CuCl2溶液 D.AgNO3溶液
4.已知空气-锌电池的电极反应为: 锌片:Zn+2OH--2e-=ZnO+H2O
石墨:O2+2H2O+4e-=4OH-根据此判断,锌片是 ( )
A.正极,并被还原 B.负极,并被还原
C.正极,并被氧化 D.负极,并被氧化
3.已知:①1 mol H2分子中化学键断裂时需要吸收436kJ的能量 ②1 mol Cl2分子中化学键断裂时需要吸收243kJ的能量 ③由H原子和Cl原子形成1 mol HCl分子时释放431kJ的能量下列叙述正确的是 ( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g) + Cl2(g) = 2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的△H =-183 kJ·mol-1
C.氢气和氯气反应生成2 mol氯化氢气体,反应的△H =183 kJ·mol-1
D.氢气和氯气反应生成1 mol氯化氢气体,反应的△H =-183 kJ·mol-1
1.下列叙述中正确的是 ( )
A.在稀溶液中1mol酸和1mol碱完全反应所放出的热量,叫做中和热
B.热化学方程式中,各物质前的化学计量数不表示分子个数
C.在101kPa时1mol物质燃烧时的反应热叫做该物质的标准燃烧热
D.如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应。 2.已知石墨转化为金刚石的过程是吸热反应,由此可知 ( )
A.金刚石硬度较小 B.金刚石比石墨稳定
C.石墨比金刚石更稳定 D.两者互为同分异构体
31.元素R,其原子核内有16个中子,已知其最高正价与负价绝对值之差为2,其气态氢化物含R 91.2%。
(1)求R的相对原子量,R质子数
(2)推断R在周期表中的位置,指出其名称。
30.(14分)利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验装置
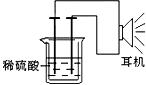
(3)原电池设计及注意的问题
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓…………”声音。其原因是:在原电池中,由化学能转化为 ,在耳机中又由 转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的 极,电极反应是: ,发生了 反应;铜钉应该接电流计的 极,电极反应是: ,发生了 反应。
29.(6分)人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
某些化学键的键能如下表(kJ·mol-1)
|
键 |
H-H |
Br-Br |
I-I |
Cl-Cl |
H-Cl |
H-I |
H-Br |
|
键能 |
436 |
193 |
151 |
247 |
431 |
299 |
356 |
(1)1 mol H2在2 mol Cl2中燃烧,放出热量 kJ。
(2)在一定条件下,1 mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的是 。
A.Cl2>Br2>I2 B.I2>Br2>Cl2 C.Br2>I2>Cl2 D.I2>Cl2> Br2
(3)预测1 mol H2在足量F2中燃烧比在Cl2中放热 ______ (填“多”或“少”)。
28.(10分)A、B、C是三种短周期元素,其中A元素原子M层上电子数比L层少2个电子;B元素原子比A元素原子的电子层少,又知B元素最高正价与负化合价的绝对值相等;C 元素的阳离子核外电子排布与Ne原子核外电子排布相同;且又知A、C元素可组成C2A型离子化合物。由上述条件回答下列问题:
(1)A、B、C三元素的名称分别是:A_______,B_______,C_______。
(2)化合物C2A的电子式是______________,
(3)C2A 与稀硫酸反应的化学方程式是:_______________________,
27.(6分)①MgCl2 ②干冰 ③冰 ④Na2O2 ⑤白磷(P4) ⑥硫磺
⑦Na2CO3 ⑧金刚石 ⑨NaOH ⑩SiO2
(1)以上物质中属于离子晶体的是 (填序号) ;
(2)属于分子晶体的是 (填序号);
(3)属于原子晶体的是_________(填序号)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com