
28.(14分)下列各单质及化合物之间的关系如下图,其中A为盐,C、M、N为日常生活中用途较广的金属单质,C是紫红色金属单质,常温下,可以用M或N制成的容器装运B的浓溶液,X具有磁性,B是工业上重要的化工原料。
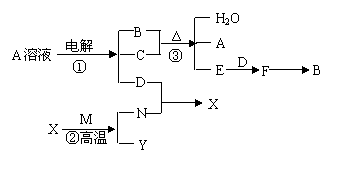

回答下列问题:
(1)N在周期表中的位置
(2)写出反应③的化学方程式
(3)写出反应①阳极的电极反应式 ,若阳极上析出的单质物物质的量为0.01 mol,则阴极上析出的物质质量为 。
(4)工业生产中F→B反应是在 (填设备名称)中进行。
(5)写出反应②的化学方程式 ,若有16.8g的 N 生成,则转移的电子数为 。
27.(18分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知①X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是 ,X2Y2的电子式 ,Z2Y2与X2Y反应的化学方程式是 .
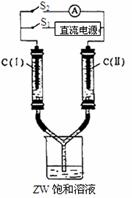
(2)如图所示装置,两玻璃管中盛满滴有酚酞的ZW的饱和溶液,C(I)、C(II)为多孔石墨电极。接通S1后,C(I)附近溶液变红,两玻璃管中有气体聚集。此时C(I)为 极,电极反应式为 。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2电流表的指针发生偏转。此时C(II)为 极, 电极反应式为 。
(3)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是: 。若该方程式同时为一套原电池装置的总反应式,则该原电池负极反应式为 ,正极反应式为: 。
26.(共16分)(Ⅰ)(8分)实验室制取Fe(OH)3胶体的方法是:向盛有沸水的小烧杯中滴加FeCl3饱和溶液1ml-2ml,待溶液呈红褐色后停止加热。
(1)制取Fe(OH)3胶体的离子反应方程式是 ,用 (方法)可将Fe(OH)3胶体精制。
(2)将制取的Fe(OH)3胶体倒入U型管并外加直流电源,通电一段时间后发生的现象是 。
(3)FeCl3溶液和Fe(OH)3胶体具有的共同性质是
A.分散质粒子的直径都在1nm-100nm之间 B.能透过半透膜
C.加热蒸干,灼烧后都有氧化铁生成 D.能透过滤纸
E.发生丁达尔效应 F.呈红褐色
(Ⅱ)(8分)恒温时,将3molA和2molB气体通入固定容积为2L密闭容器中发生反应:
 3A(g) + B(g ) xC (g) 。2min时反应处于平衡状态,此时容器内剩余1.8molB,并测得C的浓度为0.4mol/L。请填写下列空白:
3A(g) + B(g ) xC (g) 。2min时反应处于平衡状态,此时容器内剩余1.8molB,并测得C的浓度为0.4mol/L。请填写下列空白:
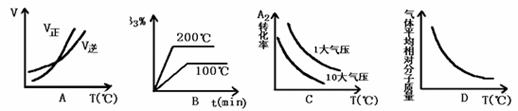
(1)x =
(2)从反应开始到平衡状态,A的平均反应速率为
(3)A的转化率与B的转化率的比为
(4)保持温度和容积不变,起始时充入a molA、b molB、c molC,欲使其反应达平衡时C的物质的量分数与上述平衡相同,则a、b、c应满足的关系为:
25.在一定条件下,将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是 ( )
A.Na2O B.Na2O2 C.Na2O和Na2O2 D.Na2O2和NaO2
|
24.
|
A.同压强、同体积的N2和CO2 B.同温度、同体积的H2和N2
C.同压强、同密度的C2H4和C3H6 D.同质量、不同密度的N2和CO
23. 对于密闭容器中的反应:A2(g)
+ 3B2(g)
2AB3(g);△H<0下列图象正确的是 ( )
对于密闭容器中的反应:A2(g)
+ 3B2(g)
2AB3(g);△H<0下列图象正确的是 ( )
22.用两根金属铂作电极,以KOH溶液作电解质溶液,从两极分别通入CH3OH(g)和O2,则对该燃料电池的下列叙述中正确的是 ( )
A.负极的电极反应式为:CH3OH + 8OH- - 6e- === CO32-+ 6H2O
B.负极的电极反应式为:4OH- - 4e- === 2H2O+O2↑
C.标准状况下,通入5.6LO2完全反应后,有0.50mol电子转移
D.工作一段时间后,通入O2的电极附近溶液的pH降低
21.下图是教材中制备Fe(OH)2示意图,下列措施不能使Fe(OH)2存在时间更长的是 ( )
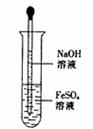
A.将蒸馏水加热煮沸并密封冷却后用来配制溶液
B.在FeSO4溶液中加入少量铁屑
C.在FeSO4溶液中加入一些植物油
D.在FeSO4溶液中加入一些四氯化碳
20.有一无色透明溶液,取出少量滴入BaCl2溶液,只有白色沉淀生成;另取一定体积的无色溶液加入过量Na2O2,有无色无味气体产生,同时有白色沉淀生成,其沉淀量与加入Na2O2的量关系如右图所示,则①H+ ②NH4+ ③Al3+ ④Mg2+ ⑤Fe2+ ⑥NO3- ⑦SO42- ⑧CO32- 中一定存在的离子是 ( )
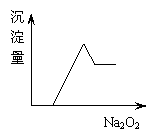

A.③④⑧ B.③④⑦ C.①③④⑦ D.②③④⑧
19.(NH4)2SO4在一定条件下发生如下反应:
4(NH4)2SO4 ==== N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体通入BaCl2溶液,产生的沉淀为 ( )
A.BaSO4 B.BaSO3 C.BaS D.BaSO4和BaSO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com