
32.(8分)[化学--物质结构与性质]
C、Si、A1是中学常见的三种元素,请根据要求填写下列空白:
(1)写出Si原子的价电子排布式 。
(2)SiC是原子晶体,其结构类型似金刚石,为C、Si两原子依次相同排列的正四面体空间网状结构。如图为一个正方体,其中心为Si原子,试在正方体的顶点画出与Si(用●)最近的C(用○表示)的位置。
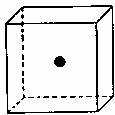
(3)CO2分子中含有的化学键类型是 ,碳原子的杂化方式是 。
(4)A1单质晶体中原子的堆积方式如下图所示,其晶胞特征如下图乙所示,原子间相互位置关系的平面图如下图丙所示。

A1单质晶体的堆积方式是 ,平均一个晶胞中A1原子数目为 。
31.(8分)[化学--化学与技术]
工业上制取CuC12的生产流程如下:
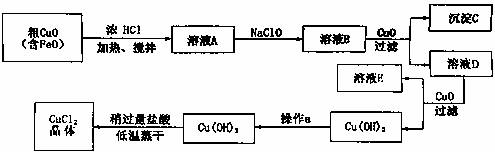
请结合下表数据,回答下列问题:
|
物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
溶度积/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
|
完全沉淀的pH范围 |
≥9.6 |
≥6.4 |
3-4 |
(1)溶液A中加入NaC1O的目的是 ;该操作中若温度较高会产生一种有害气体,写出产生该有害气体的反应方程式 。
(2)在溶液B中加入CuO的作用是 。
(3)操作a的目的是 。
(4)在Cu(OH)2中加入盐酸使Cu(OH)2转变为CuC12时采用稍过量盐酸和低温蒸干的目的是 。
30.(17分)某化学研究性学习小组讨论Fe2+和SO32-之间发生怎样的反应,提出了两种可能。一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生相互促进的水解反应:2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填空:
实验Ⅰ:学生选择的实验用品:Na2SO3浓溶液、BaC12稀溶液、稀盐酸;试管若干、胶头滴管若干,从选择的药品分析,设计这个实验的目的是 。
实验Ⅱ:取5mL FeC13浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色、变为红褐色,无气泡产生,无沉淀生成,继续加入Na2SO3 溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是
。将溶液分成两等份,其中一份加入KSCN溶液,溶液变为血红色,反应的离子方程式为 。另一份中加入BaC12稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 。
实验Ⅲ:换用稀释的FeC13和Na2SO3溶液,重复实验Ⅱ,产生的现象完全相同。由上述实验得出的结论是 。若在FeC13溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是 。
从形式上看,Na2CO3、Na2SO3相似,但是从上述实验中可以看出,二者的水溶液与FeC13溶液反应的现象差别很大,分析其原因可能是:
①
② 。
[必做部分]
共8个题,考生从中选择2个物理题、1个化学题和1个生物题。
29.(10分)
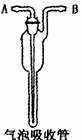
(1)二氧化硫是造成空气污染的主要物质之一,我国已将二氧化硫列为一种主要的法规控制空气污染,并将大气中二氧化硫的浓度水平作为评价空气质量的一项重要指标。下图所示是一种测定空气中二氧化硫含量的装置,气体从 口通入,若吸收管内是高锰酸钾酸性溶液,吸收终点的现象是 ,若吸收管内是一定浓度的氢氧化钠溶液,若要观察到明显的现象,需向溶液中加入 。
(2)在容积不变的密闭容器中有如下反应:2SO2(g)+O2(g) 2SO3(g)△H<0。某研究小组对此反应进行了当其他条件不变时,改变某一条件对上述反应影响的研究,下列分析正确的是
。
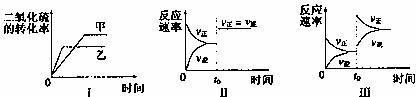
①图Ⅰ研究是是温度对化学平衡的影响,且乙的温度较高
②图Ⅱ研究的是催化剂对反应速率的影响,化学平衡不移动
③图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
④图Ⅲ研究的是t0 时刻增大O2的浓度对反应速率的影响
(3)某混合气体CO2和SO2的混合物,试画出除去SO2并收集一瓶CO2的装置图。

28.(15分)某溶液可能含有以下离子中的几种离子(K+、Mg2+、A13+、Ba2+、NO-3、SO42-、C1-、I-、HCO3-)。-化学课外活动小组进行了如下实验:
|
实验步骤 |
实验操作 |
实验现象 |
|
① |
用pH试纸测溶液的pH |
PH试纸呈红色 |
|
② |
少许溶液加入氯化钡溶液 |
有白色沉淀生成 |
|
③ |
取②中层清夜,加入AgNO3溶液 |
有白色沉淀生成 |
|
④ |
取少量该溶液,加入NaOH溶液至过量 |
先有白色沉淀生成,后有沉淀全部消失 |
|
⑤ |
取少量该溶液,加铜片和少量浓硫酸,加热 |
铜片上产生无色气体,气体遇空气变红棕色 |
请判断:
(1)此溶液中一定存在的离子有 ,一定不存在的离子是 。
(2)对NO-3作出以上判断的原因是(用离子方程式表示) 。
(3)对上述实验未能确认的离子,请模仿上述形式,设计实验确认这些离子的存在(可填满也可不填满)
|
待确认的离子 |
实验步骤 |
实验现象 |
|
|
|
|
|
|
|
|
|
|
|
|
2. 第Ⅱ卷所有题目的答案考生须用黑色0.5mm的墨水签字笔答在答题纸上,在试题卷上答题无效。
[必做部分]
1. 第Ⅱ卷共16个题。其中23-30题为必做部分,31-38题为选做部分。考生必须从选做题中选择2个物理题、1个化学题和1个生物题作答。不按规定选做者,阅卷时将根据所选科目题号的先后顺序只判前面的2个物理题、1个化学题和1个生物题。其他作答的题目答案无效。
15.将4molA 气体和2 molB气体在2L的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g) 2C(g)△H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol·
L-1,下列说法中正确的是 ( )
A.反应过程中,当A、B、C的物质的量浓度之比为2:1:2时,反应即达到平衡状态
B.4s内用物质B表示的反应速率为 0.075mol·L-1·s-1
C.达平衡后保持体积不变,A、B、C均减小1mol,平衡向右移动
D.达平衡后若升高温度,C的浓度将增大
第Ⅱ卷(必做120分+选做32分,共152分)
|
14.已知甲、乙、丙是常见的含有同一种金属元素的化合物,这种三物质之间的转化关系如下图,下列的说法不正确的是 ( )
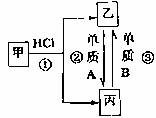
A.乙和丙的水溶液均显酸性
B.反应①②③均是氧化还原反应
C.甲、乙、丙三种化合物中的共同元素一定与A或B中的元素相同
D.将乙和丙的水溶液分别在空气中蒸干、灼烧至质量不再变化时,所得固体物质相同
13.A、B、C三种短周期元素在同期表中的位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和与C的质子数相等,现有以下说法,其中判断正确的组合是 ( )
①B与C均存在同素异形体
②X的种类比Y的种类数多
③常温下,B氢化物中H+浓度一定比A的氢化物水溶液中的H+浓度大
④A和B的氢化物均是弱电解质
A.①②③④ B.①②③ C.①②④ D.②③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com