
19.(10分)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式如下:
CH3COOH+C2H5OH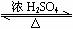 CH3COOC2H5+H2O
CH3COOC2H5+H2O
(1)该反应的平衡常数表达式K= 。
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
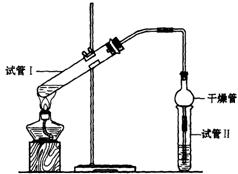
|
实验 编号 |
试管Ⅰ中的试剂 |
试管Ⅱ中试剂 |
测得有机层的厚度/cm |
|
A |
2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 |
饱和碳酸钠 溶液 |
5.0 |
|
B |
3mL乙醇、2mL乙酸 |
0.1 |
|
|
C |
3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 |
1.2 |
|
|
D |
3mL乙醇、2mL乙酸、盐酸 |
1.2 |
① 实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是 mL和 mol/L。
② 分析实验 (填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是
。
③ 加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 。
18.在t℃时,将agNH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρg·cm-3,质量分数为ω,其中含NH4+的物质的量为b moL。下列叙述中正确的是 ( )
A.溶质的质量分数为ω=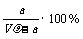
B.溶质的物质的量浓度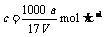
C.溶液中c(OH-)=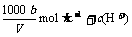
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
17.下述实验能达到预期实验目的的是 ( )
|
编号 |
实验内容 |
实验目的 |
|
A |
将10g CuSO4·5H2O溶解在90g 水中 |
配制质量分数为10%的CuSO4溶液 |
|
B |
向盛有1 mL硝酸银溶液的试管中滴加KI溶液,至不再有沉淀生成,再向其中滴加NaCl溶液 |
说明一种沉淀能转化为溶解度更小的沉淀 |
|
C |
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 |
研究浓度对反应速率的影响 |
|
D |
室温下,用pH计测定浓度为0.1mol·L-1NaClO溶液和CH3COONa溶液的pH |
比较HClO和CH3COONa的酸性强弱 |
16.常温下,下列各组数据中比值为2:1的是 ( )
A.电解熔融氯化钠,在阴极和阳极上析出产物的物质的量之比
B.中和体积相同、pH相同的硫酸和盐酸消耗NaOH的物质的量之比
C.1 mol·L-1氨水溶液与0.5 mol·L-1氨水溶液中c(OH-)之比
D.物质的量相同的水和乙醇与足量金属钠反应产生氢气的体积之比
15.某醋酸溶液与0.01 mol·L-1 NaOH溶液等体积混合(忽略溶液体积变化),混合后溶液显中性。则下列有关叙述不可能出现的是 ( )
A.混合液中c(Na+)=c(CH3COO-)
B.该醋酸溶液中c(H+)=0.01 mol·L-1
C.该醋酸溶液的物质的量浓度大于0.01 mol·L-1
D.混合液中c(CH3COOH)+c(CH3COO-)=0.005 mol·L-1
14.铅蓄电池用途极广,电解液为30% H2SO4溶液,电池的总反应式可表示为:
Pb(s)+PbO2(s)+2H2SO4(aq)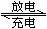 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l)
下列有关叙述正确的是 ( )
A.放电时电解液的密度不断增大
B.放电时电子从Pb通过导线转移到PbO2
C.充电时Pb极与外电源的负极相连
D.充电时PbO2电极发生还原反应,Pb电极上发生氧化反应
13.短周期元素X和Y,X原子的电子层数为n,最外层电子数为(2n+1),Y原子最外层电子数是次外层电子数的3倍。下列说法一定正确的是 ( )
A.X和Y都是非金属元素,其中X的最高化合价为+5价
B.X与Y所能形成的化合物都是酸性氧化物
C.元素X可形成化学式为KXO3的盐
D.X的氢化物极易溶于水,可以用来做喷泉实验
12.利用反应:2NO(g)+2CO(g)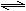 2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是 ( )
2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是 ( )
A.降低温度 B.增大压强同时加催化剂
C.升高温度同时充入N2 D.及时将CO2和N2从反应体系中移走
11.下列反应的离子方程式书写正确的是 ( )
A.碳酸氢钙溶液与稀硝酸反应:HCO3-+H+=CO2↑+H2O
B.水玻璃中通入过量二氧化碳气体:SiO32-+CO2+H2O=H2SiO3+CO32-
C.浓烧碱溶液中加入铝片:Al+OH-+H2O=AlO2-+H2↑
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:
2H++SO42-+Ba2++OH-=BaSO4↓+2H2O
10.短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是( )
|
C.离子半径:W2+>Y2- D.碱性:XOH>W(OH)2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com