
27.(10分)下表列有几种物质的沸点:
(1)
|
物质 |
AlF3 |
AlCl3 |
AlBr3 |
Al2O3 |
MgCl2 |
MgO |
|
沸点/℃ |
1260 |
181(升华) |
263 |
2045 |
707 |
2850 |
①下列各组物质中,气化或者熔化时所克服的粒子间作用力类型分别与氟化铝和溴化铝相同的是 。
A.NaCl和CCl4 B.Na2O和SiO2
C.金刚石和金属铝 D.碘和干冰
②工业上制备金属镁,应采用电解熔融的 。
A.MgCl2 B.MgO
③工业上制备金属铝,是采用电解熔融Al2O3(加冰晶石),而不是电解熔融AlCl3,原因是 。
(2)过渡元素钴(27Co)的原子核外电子排布式为 。钴有两种化学式均为Co(NH3)2BrSO4的配合物,且配位数均为6。它们分别溶解于水时电离出的阳离子的化学式可能为 和 。鉴别两者的实验方法是:分别取样并滴加 (填化学式)溶液。
26.(10分)丁烯二酸(HOOCCH=CHCOOH)是一种用途广泛的有机合成中间体。
(1)反式丁烯二酸又叫富马酸,其结构简式是 。
(2)用石油裂解中得到的1,3-丁二烯合成丁烯二酸时,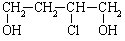 是关键的中间产物。请用反应流程图表示从H2C=CH-CH=CH2到
是关键的中间产物。请用反应流程图表示从H2C=CH-CH=CH2到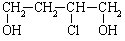 的变化过程。 。
的变化过程。 。
提示:①合成过程中无机试剂任选。
②1,3-丁二烯的1,2-加成和1,4-加成是竞争反应,到底是哪一种加成占优势,取决于反应条件。
③合成反应流程图表示方法示例如下:A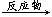 B
B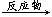 C……
C……
(3)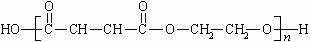 是由两种单体缩聚而成,这两种单体是
和
(填结构简式)。
是由两种单体缩聚而成,这两种单体是
和
(填结构简式)。
25.(10分)
(1)下表是在1.013×105Pa下测得的几种物质的沸点:
|
结构简式 |
沸点/℃ |
结构简式 |
沸点/℃ |
|
CH3CH3 |
-88.6 |
CH2=CH2 |
-103.7 |
|
CH3CH2CH3 |
-42.2 |
CH2=CHCH3 |
-47.4 |
|
CH3CH2CH2CH3 |
-0.5 |
CH3CH2CH=CH2 |
-6.3 |
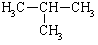 |
-11.7 |
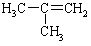 |
-6.9 |
|
CH3CH2CH2CH2CH3 |
36.1 |
CH3CH2CH2CH=CH2 |
30 |
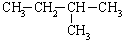 |
|
 |
20.1 |
从表中数据分析,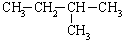 在1.013×105PA.25℃时的状态是 (填气态、液态或固态)。
在1.013×105PA.25℃时的状态是 (填气态、液态或固态)。
(2)石油裂解是一个复杂的过程,其产物为混合物。例如:
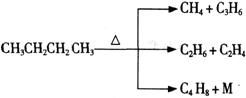
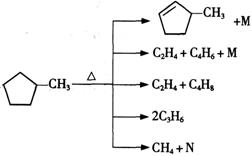
①上述烷烃和环烷烃裂解反应中,产物M的化学式为 ,N的化学式为 。
②下列关于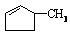 的说法正确的是
。
的说法正确的是
。
A.可用溴水区别 和
和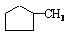
B.等质量的 和
和 完全燃烧时的耗氧量相同
完全燃烧时的耗氧量相同
C. 可与水以任意比互溶
可与水以任意比互溶
(3)工业上裂解反应的产物都是气态小分子烷烃和烯烃的混合物,将它们逐一分离的方法是
。
24.(13分)水体中二价汞离子可以与多种阴离子结合成不同的存在形态。水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示:
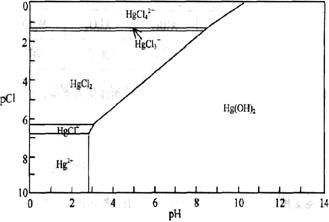
(注:粒子浓度很小时常用负对数表示,如pH=-lgc(OH-),pCl=-lgc(Cl-)):
(1)正常海水(Cl-的浓度大于0.1mol/L)中汞元素的主要存在形态是
。少量Hg(NO3)2溶于0.001mol/L的盐酸后得到无色透明溶液,其中汞元素的主要存在形态是
。
(2)Hg(NO3)2固体易溶于水,但溶于水时常常会出现浑浊,其原因是 (用离子方程式表示),为了防止出现浑浊,可采取的措施是
。
(3)处理含汞废水的方法很多。下面是常用的两咱方法,汞的回收率很高。
①置换法:用废铜屑处理含Hg2+的废水。反应的离子方程式为
。
②化学沉淀法:用硫化钠处理含HgCl2的废水,生成HgS沉淀。反应的离子方程式为 。
(4)汞虽然有毒,但用途广泛。用汞和溴化钙作催化剂,可以在较低温度下经过下列反应使水分解制氢气和氧气:
①CaBr2+2H2O=Ca(OH)2+2HBr↑
②……
③HgBr2+Ca(OH)2=CaBr2+HgO+H2O
④2HgO=2Hg+O2↑
反应②的化学方程式为 。
23.(11分)从含镍废催化剂中可回收镍,其流程如下:
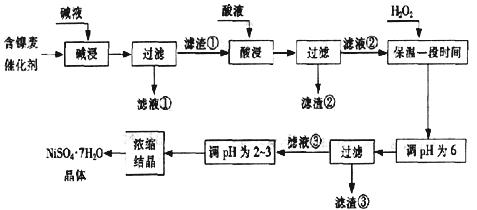
某油脂化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。部分阳离子以氢氧化物形式完全沉淀时的pH中下:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
9.2 |
回答下列问题:
(1) “碱浸”的目的是除去 。
(2)“酸浸”时所加入的酸是 (填化学式)。酸浸后,滤液②中可能含有的金属离子是 。
(3)“调pH为2~3”的目的是 。
(4)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),可能是由于生产过程中
导致Fe2+未被完全氧化造成的。
(5)NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH。该反应的离子方程式是 。
22.(10分)下表是元素周期表主族元素的一部分。
|
W |
X |
Y |
|
|
|
Z |
短周期元素X的最高正价是+5价,Y单质可在空气中燃烧。
(1)Z的元素符号是 ,原子结构示意图中 。
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,反应的化学方程式为 。
(3)探寻同一主族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式。
|
编号 |
性质推测 |
化学方程式 |
|
示例 |
氧化性 |
H2ZO3+4HI=Z↓+2I2+3H2O |
|
1 |
|
|
|
2 |
|
|
(3)请设计实验方案进一步确定该固体混合物的组成。叙述实验操作、预期现象和结论。
|
实验操作 |
预期现象和结论 |
|
|
|
|
|
|
取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液A,同时闻到有轻微的刺激性气味。用胶头滴管取少量溶液A于试管中,再滴加稀硝酸,溶液中有无色气泡产生;继续滴加过量稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。
(1)用 (填实验用品名称)取固体混合物于烧杯中。
(2)上述实验可以得到的初步结论是 。
21.(10分)已知某白色混合物粉末中含有CuSO4、K2SO4、NH4HCO3、NH4Cl、NaCl五种物质中的两种,且物质的量之比为1:1。请完成下述探究混合物组成的实验。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子;红色石蕊试纸、淀粉碘化钾试纸;1mol/L硫酸、1mol/L硝酸、1mol/L盐酸、1mol/L NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
20.(13分)印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl2 1.5mol/L,含FeCl2 3.0mol/L,含FeCl3 1.0mol/L,含HCl 3.0mol/L。取废腐蚀液200mL按如下流程在实验室进行实验:
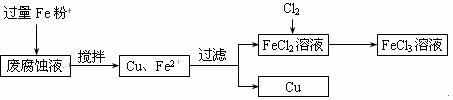
回答下列问题:
(1)上述方法获得的铜粉中含有杂质,除杂所需试剂是 (填化学式)。
(2)实验室可用固体KClO3与浓HCl反应制备Cl2,此反应中Cl2既是氧化产物,又是还原产物。反应的化学方程式为 。
(3)下图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。
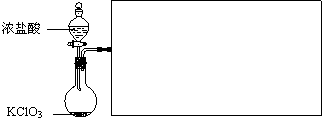

从下图挑选所需的仪器,完成上述装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明容器中所装试剂。


(4)实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收。控制生成氯气速度的操作是: 。
(5)按上述流程操作,需称取Fe粉的质量应不少于 g(精确到0.1g),需通入Cl2的物质的量不少于 mol,加入烧瓶中的KClO3的质量应不少于 g(精确到0.1g)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com