
25.(14分)
(1)有下图所示A、B、C、D四种仪器:请选择下列仪器名称的序号,填入相应的空格内:
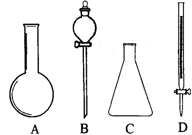
①蒸馏烧瓶
②普通漏斗
③圆底烧瓶
④锥形瓶
⑤分液漏斗
⑥酸式滴定管
⑦碱式滴定管
A___________ B_________ C_________ D_________(各1分)
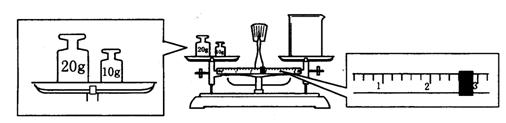
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是__________(2分),烧杯的实际质量为__________g.(2分)
(3)指出下面3个实验中各存在的一个错误:
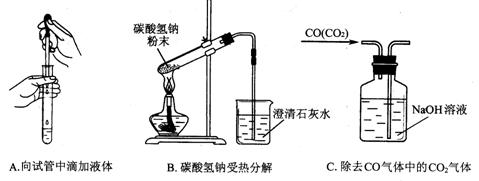
A_____________,B________________,C__________________(各2分)
13.某温度下,甲、乙两个烧杯分别盛有相同浓度的KCl溶液100g。现将甲烧杯中的溶液蒸发掉35g H2O,析出晶体5g;乙烧杯中的溶液蒸发掉45g H2O,析出晶体10g。则原溶液中KCl的质量分数为 ( )
A. 25% B. 20% C. 15% D. 10%
第Ⅱ卷(必考题129分,选考题45分,共174分)
|
12.下列反应的离子方程式中正确的是 ( )
A. 稀硝酸与过量的铁屑反应: 3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
B. 硫酸铝溶液与过量的 氨水反应:
氨水反应: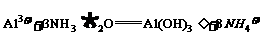
C. 苯酚钠的水溶液中通入少量的CO2:2C6H5O¯+CO2+H2O→2C6H5OH+CO32-
D. 醋酸钠的水解反应:CH3COO-+H3O+=CH3COOH+H2O
11.已知0.1mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是 ( )
A. 在Na2A、NaHA两溶液中,离子种类相同
B. 在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C. NaHA溶液PH一定大于7
D. 在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)> c(OH-)
9. 已知:C(s)+CO2(g)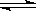 2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
( )
2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
( )
A. 降低温度和增大压强 B. 降低温度和减小压强
C. 升高温度和减小压强 D.升高温度和增大压强
|
|
编号 |
实验内容 |
实验目的 |
|
A |
将SO2通入酸性KMnO4溶液中 |
证明SO2具有氧化性 |
|
B |
将Cl2通入NaBr溶液中 |
比较氯与溴的氧化性强弱 |
|
C |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失 |
证明此溶液是Na2SiO3溶液 |
|
D |
分别向2支试管中加入相同体积但不同浓度的H2O2溶液,再向其中1支加入少量MnO2 |
研究催化剂对H2O2分解速率的影响 |
8.下列叙述正确的是 ( )
A.欲配制质量分数为10%的ZnSO4溶液,将10g ZnSO4·7H2O溶解在90g水中
B.常温常压下,22.4L的NO2气体含有1.81×1024个原子
C.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量即可
D.目前使用的元素周期表中,最长的周期含有36种元素
7.历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中错误的是 ( )
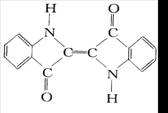
A.靛蓝由碳、氢、氧、氮四种元素组成
B.它的分子式是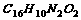
C.它可以在一定条件下与氢气发生加成反应
D.该物质是高分子化合物
29.(15分)煤的气化的液化不仅可以使煤变成清洁的能源,也是化工原料的重要来源之一,下图是由煤气化后的产物进行化学合成的一系列转化,其中,F分子中的碳原子数是E的3倍;E分子中含有两个相同的官能团,且两个官能团不边顺同一个碳原子上;M分子中含有4个碳原子。其它与本题无关的生物均已略去。
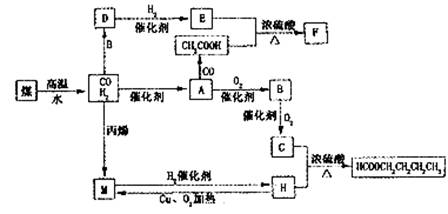
请回答下列问题:
(1)写出下列物质的结构简式并回答问题:
A为___________;D为___________;A与H两物质相互关系是___________。
(2)写出下列反应的化学方程式并指出E→F的反应类型:CH2COOH+E→F__________,反应类型____________;M与新制的氢氧化铜悬浊液共热_______。
(3)与H互为同分异构体且与H含有相同官能团,但在碳链不变的情况下不能催化氧化的化合物结构简式为______________。
28.(15分)利用Na2O2与水反应能放出氧气的性质,可通过选择装置A或B来测定已部分变质的Na2O2样品中Na2O2的质量分数。
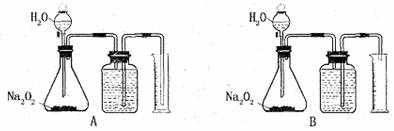
(1)实验室提供的是500mL量筒,则实验中取用Na2O2样品的质量最合适的是_______。
A.0.1~0.2g B.2.5~3.0g C.5.0~6.0g D.10~15g
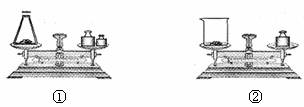
(2)如图托盘天平称取样品,应选用下图中的_________(填①或②)。不选用另一装置的原因是_______________。
(3)因Na2O2与水反应会放热而影响测定的准确性,所以反应结束后,必须使锥形瓶中的气体温度降低至室温,应选用装置A、B中的________(填A或B)。如果选用了另一种不适当的装置,测得的Na2O2的质量分数会________(填偏大或偏小),原因是___________。
(4)如在实验中,气体摩尔体积为a L·mol-1,量筒中收集到的水的体积为V mL,样品的质量为m g,则样品中Na2O2的质量分数为________________。
27.(15分)A~F都是中学化学常见物质,它们间的相互转化关系如下图所示,其中A、D、F是化合物,E是非金属单质。
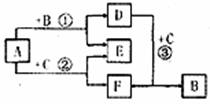
(1)若B、C都是非金属单质,则B、C、E三者的氧化性由强到弱的顺序是_________。
(2)若B是金属单质,C是非金属单质,则E的分子式是________,反应②的化学方程式是_____________。
(3)若B、C都是化合物,则E的分子式是_________,反应①中每生成1molE转移电子的物质的量是____________,反应离子方程式是_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com