
13.下列说法正确的是 ( )
A. 白磷晶体中,微粒之间通过共价键结合,键角60℃
B. 由主族元素构成的某离子化合物中,一个阳离子和一个阴离子核外电子数之和为20。晶体中阳离子和阴离子个数一定相等
C. (NH4)2PtC16晶体受热分解,生成氮气、氯化氢、氯化氨和金属铂。在此反应中,氧化产物与还原产物的物质的量之比为4:3
D.向NaOH溶液中滴加同浓度的少量Ca(HCO3)-2溶液,其离子方程式为:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
第Ⅱ卷(非选择题,共10题,共174分)
12.常温下,甲、乙均为1L 0.1mol/L氨水,其pH为11。
①甲用蒸馏水稀释100倍后,溶液的pH=a
②乙与1L 0.2mol/L盐酸混合,在混合溶液中:n(NH+4)+n(H+)-n(OH-)=b mol。则a、b正确的组合是 ( )
A.9-10之间、0.1 B.9-11之间、0.2
C.12-13之间、0.2 D.13、0.2
11.根据元素周期律及晶体结构与性质判断,下列各项叙述中正确的组合是 ( )
①同一主族元素,原子半径越大,非金属单质的熔点一定越高
②同一周期元素的原子,半径越大越容易失去电子
③同一主族元素的氢化物,相对分子质量越大,它的沸点一定越高
④若X是原子晶体,Y是分子晶体,则熔点:X>Y
⑤若A2+2D-=2A-+D2,则还原性:D->A-
⑥若R2-和M+的电子层结构相同,则原子序数:R>M
⑦若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB
⑧VIA族元素的氢化物中稳定性最好的,其沸点也最高
A.①③⑤⑦ B.②④⑥⑧ C.①②③④⑥⑦⑧ D.①②④⑤⑦⑧
10.某有机物分子中含有n个-CH2-、m个-C-、a个-OH,其余为甲基。则甲基的数
|
A.m+2-a B.n+m+a C.2n+3m-a D.m+2n+2-a
9.经分析某物质中仅含有一种元素,此物质 ( )
A.一定是一种单质 B.一定是一种纯净物
C.一定是混合物 D.可能是纯净物也可能是混合物
8.下列说法正确的是 ( )
A.标准状况下22.4L辛烷完全燃烧,生成二氧化碳分子为8NA(NA代表阿伏加德罗常数值)
B.镁、铝制造的容器可用来盛放浓HNO3,镁、铝都能与强碱溶液反应放出氢气
C.除去乙醇中少量的乙酸:加足量生石灰,蒸馏
D.钢铁在潮湿空气中发生电化学腐蚀时,正极发生的主要反应是2H2O+O2-4e-=4OH-
7.下列是说法正确的是 ( )
A.用米汤可以检验加碘食盐中的碘酸钾(KIO3)
B.电解池的阳极发生还原反应,阴极发生氧化反应
C.氢氧化铁胶体加热凝聚、胆矾常温下变白均是化学变化
D.皮肤上不慎沾上了苯酚,应立即用酒精清洗
6.常温下,某无色溶液由水电离出来的c(H+)为1×10-13mol/L,溶液中能大量共存的一组离子为 ( )
A.Na+、NO3-、MnO4-、CO32- B.NH4+、CH3COO-、Ba2+、NO3-
C.H+、I-、NO3-、K+ D.A1O2-、HCO3-、OH-、Na+
27.(15分)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
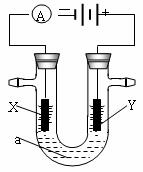
(1)X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则电解池中总反应的离子方程式为 (3分),在X极附近观察到的实验现象是 (2分)。检验Y电极反应产物的方法是 (2分)。
(2)若想用电解实验制得白色纯净的Fe(OH)2沉淀,a仍是饱和NaCl溶液,则Y电极反应式为 (2分),往U型管添加完饱和NaCl溶液后需加入少量苯,苯的作用是 (2分)。
(3)若想用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是 (2分), Y电极反应式为 (2分)。
选考题(每科选做1题,共做3题)
26.(14分)有A、B、C三种常见的短周期单质,A为自然界中最硬的单质,B可与冷、浓硫酸发生钝化,C为淡黄色的固体。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液显强酸性;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图,请回答:
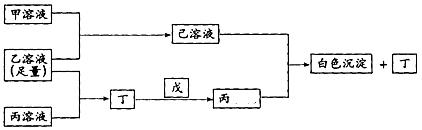
(1)写出C元素的原子结构示意图__________,(2分)写出戊的电子式__________;(2分)
(2)乙溶液呈强酸性的原因___________________________(用电离方程式表示,2分);丙溶液呈碱性的原因_____________________________;(用化学反应方程式表示,2分)
(3)写出有关反应的离子方程式
①乙溶液+丙溶液→丁_________________________________________;(3分)
② 己溶液+丙溶液→丁_________________________________________。(3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com