
7.下列反应中,能说明卤素单质的氧化性强弱顺序为Cl2>Br2>I2的是 ( )
①2HClO4+Br2=2HBrO4+C12↑ ②2NaBr+C12=2NaC1+Br2
③2KI+C12=2KC1+I2 ④2KI+Br2=KBr+I2
A.①②③ B.①②④ C.②③④ D.①②③④
6.下列叙述中,正确的是 ( )
A.原子晶体中只含有非极性键
B.金属在常温时都以金属晶体形式存在
C.离子晶体一定是由金属与非金属元素组成
D.分子晶体中一定有分子间作用力,有的还可能有氢键
5.下列说法中正确的是(NA代表阿伏加德罗常数) ( )
A.9g水所含的质子数为9NA
B.常温常压下,活泼金属从盐酸中置换出1mol H2,转移的电子数目为2NA
C.1mol/L的Na2CO3溶液100mL中含CO32一离子数为0.1NA
D.常温常压下,22.4L CO2所含原子数为3NA
4.下列说法或表示法正确的是 ( )
A.氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多
B.需要加热的反应说明它是吸热反应
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
D.1molS完全燃烧放热297.3kJ,其热化学方程式为:S+O2=SO2,△H=-297.3kJ/mol
3.在下列反应中,水既不是氧化剂又不是还原剂的是 ( )
|
C.C12+H2O=HC1+HClO D.2H2O O2↑+2H2↑
l.金属钛(Ti)常被称为未来钢铁,钛元素的同位素4622Ti、4822Ti、4922Ti、5022Ti中,中子数不可能为 ( )
A.24 B.26 C.28 D.30
2.下列关于生活中的化学知识叙述正确的是 ( )
A.某种口服液含丰富的氮、磷、锌等微量元素
B.用纯碱溶液除去水壶中的水垢
C.硫酸铜可用于游泳池池水的消毒,也可用于自来水消毒
D.加碘食盐开袋后,不宜长期放置后食用
29.(12分)化学工业中,硫酸是重要的化工产品。
(1)硫酸生产过程中,根据化学平衡原理来确定的条件或措施有 (填序号)。
A.矿石加入沸腾炉之前先粉碎
B.V2O5作催化剂
C.接触室中不使用很高的温度
D.净化炉气中要有过量的空气
E.接触氧化在常压下进行
F.吸收塔中用98.3%的浓硫酸吸收SO3
(2)若实验在537℃、1.01×105Pa和催化剂存在条件下,向某密闭容器中充入1molSO2和0.5molO2,此时体积为100L,在温度和容积不变条件下反应达到平衡,SO3体积分数为 0.91。若保持温度和容积不变,充入1molSO3(q),则平衡时SO2体积分数为 ,若保持温度和压强不变,充入a molSO2和b molO2,且a:b=2:1,反应平衡时总体积为100L,SO3体积分数仍为0.91,则a= 。
(3)硫酸工业的尾气中含有少量的SO2,常用氨水吸收后再加硫酸,回收SO2同时得到化肥硫酸铵,硫酸铵溶液中各离子物质的量浓度由大到小的顺序为 。
28.(20分)某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe2++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了弄清是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ 实验用品Na2SO3浓溶液、BaC12稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,实验者设计这个实验目的是 。
实验Ⅱ 取5mL FeC13浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色物质是 。向红褐色物质中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为 。另一份加入BaC12稀溶液,有少量白色沉淀的离子方程式是 。
实验Ⅲ 换用稀释FeC13和Na2SO3溶液重复实验Ⅱ,产生的现象完全相同。由上述实验得出的结论是 。若FeC13浓溶液中加入Na2CO3浓溶液,观察到产生红褐色沉淀和无色气体,该反应的离子反应方程式是 。从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,两者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:① ;② 。
27.(13分)图16中每一方框内的字母代表一种反应物或生成物。已知:C、D、F是常见的气体,D可用于焊接和切割金属,J是生活中常见的一种塑料的主要成分,H可用于漂白和消毒杀菌。
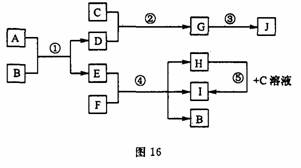
请填空:
(1)A的晶体中存在的化学键: ,D的结构简式: 。
(2)反应③的化学方程式: 。反应⑤的离子方程式: 。
(3)H在空气中变质的化学反应方程式: 。
(4)D、F两种气体在水下相遇,立即闪现明亮火球并有大量浓黑的烟絮上升,水溶液呈强酸性。若该反应产生1.2g黑色单质时放热51.65kJ,则反应的热化学方程式为 。
26.(15分)图15表示各物质之间的转化关系(部分反应物没有给出)。
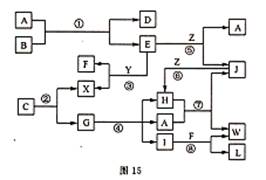
已知:
Ⅰ.A是无色液体,L是不溶于稀硝酸的白色沉淀,E、F、H、J、X、Y、Z是气体;
Ⅱ.G、X、Y、Z是单质,其他是化合物,其中Y呈黄绿色,H呈红棕色,E和F都极易溶于水,两者相遇有白烟生成;
Ⅲ.B和C都是由一种金属与一种非金属元素组成的化合物,其中非金属元素相同且质量分数都是28%,组成B金属元素原子核外的K层和M层电子数相同。
请按要求填空:
(1)写出下列物质A的电子式 ,X的结构式 ;
(2)工业上制取硝酸的反应有(填写反应代号): ;
(3)写出下列物质的化学式:B ,C ;
(4)反应④的化学方程式为: 。
(5)保持容器的温度和体积不变,在反应③刚好完全发生时,反应前后容器的压强之比为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com