
2.下列描述正确的是 ( )
A.“酸雨”是指pH小于7的降水
B.城市空气质量日报中的主要污染指标包括SO2、CO2和可吸入颗粒物
C.造成臭氧层空洞的主要原因是人类大量使用化石燃料
D.氮氧化物是造成光化学烟雾的主要原因之一
1.下列各组物质熔解时所破坏的微粒间作用类型相同的是 ( )
A.SiO2晶体与CO2晶体 B.NaCl与AlCl3
C.冰与干冰 D.石墨与C60
29.(10分)
下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
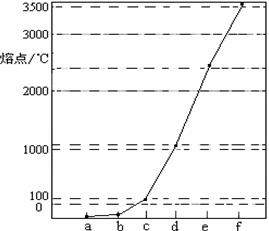
(1)请写出上图中b单质对应元素原子的电子排布式 。
(2)单质a、f对应的元素以原子个数比1 :1形成的分子(相同条件下对H2的相对密度为13)中含 个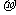 键和 个
键和 个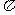 键。
键。
(3)a与b的元素形成的10电子中性分子X的空间构型为 ;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为 ,其中X与Ag+之间以 键结合。
(4)下图是上述六种元素中的一种元素形成的含氧酸的结构:
请简要说明该物质易溶于水的原因 。
28.(10分)
精神病学专家通过实验发现:在大脑的相应部位-“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态。人们已经将“奖赏中心”部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统。多巴胺结构如图。请回答下列问题:
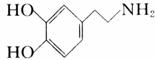
(1) 多巴胺分子式 。
(2)试推测多巴胺能发生的反应类型 。
A. 消去 B. 取代 C. 加成 D. 水解
(3)多巴胺可由香兰素与硝基甲烷制得,合成过程表示如下:
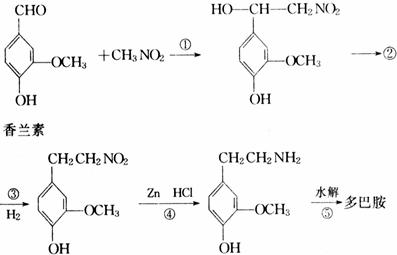
Ⅰ.0.5mol香兰素发生银镜反应,最多可生成 mol Ag 。
Ⅱ.②的结构简式是 ,生成②的反应类型 。
Ⅲ.写出④、⑤步的化学方程式:
④ 。
⑤ 。
27.(9分)
分子式为C13H16O2的惕各酸苯乙酯广泛用于香精的调香剂。已知:
① R-CH2Cl
+ NaOH  R-CH2OH + NaCl
R-CH2OH + NaCl
②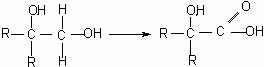
为了合成该物,某实验室的科技人员设计了下列合成路线:
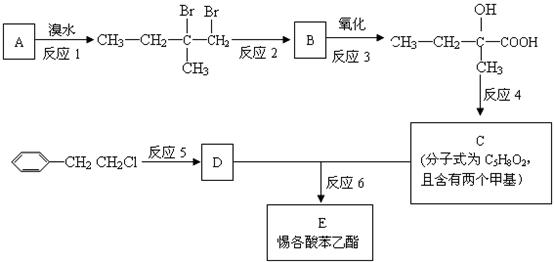
试回答下列问题:
(1)试写出:A的名称_______________;D的结构简式________________。
(2)反应4的一般条件是______________。
(3)上述合成路线中属于取代反应的是 (填编号)。
(4)反应①的化学方程式为 。
26.(12分)
某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)
共同生产MnO2和Zn(干电池原料):
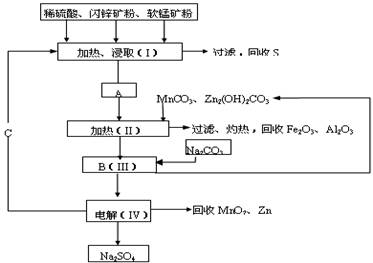
已知① A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
② IV中的电解反应式为MnSO4+ZnSO4+2H2O MnO2+ Zn+2H2SO4。
MnO2+ Zn+2H2SO4。
(1)A中属于还原产物的是__________ ______。
(2)MnCO3、Zn2(OH)2CO3的作用是 ;II需要
加热的原因是 ;C的化学式是___________________。
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是_______________________。
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是___________。
(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进行的操作有蒸发浓缩、
________、过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是__________。
25.(9分)
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨的原理是:
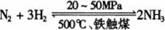 △H <0,生产流程如图所示。
△H <0,生产流程如图所示。
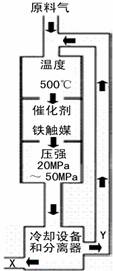
①X的化学式为 ;
②图中条件选定的主要原因是(选填字母序号) ;
A.升高温度、增大压强均有利于氨的合成
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
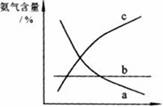
③ 改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号) ,当横坐标为温度时,变化趋势正确的是(选填字母序号) 。
(2)常温下氨气极易溶于水,其水溶液可以导电。
④ 用方程式表示氨气溶于水且显弱碱性的过程:
;
⑤ 氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
⑥ 将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小
依次为 。
24. (10分)
I .下图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:
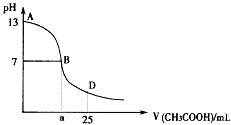
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,
这种看法是否正确? (选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内? 区间(若正确,此问不答)
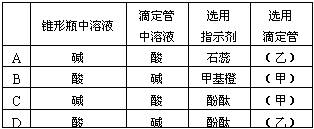
(2)关于该滴定实验,从下列选项中选出最恰当的一项 。(选填字母)
(3)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH) 2c(Na+)。
(填“>”、“<”或“=”)
II.t℃时,某稀硫酸溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13 :
(5)该温度下水的离子积常数K w的数值为 。
(6)该温度下(t℃),将100mL 0.1 mol·L-1的稀H2SO4溶液与100mL 0.4 mol·L-1的
NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH= 。
23.(10分)
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜反应的情况,回答下列问题:
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为 。
某同学未加入氧化剂,而是设计了一个实验装置,也能使铜很快溶于稀盐酸。请在方格中画出该装置:

(2)在一定体积的18 mol·L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9mol,则该硫酸的实际体积 (填大于、等于或小于)100mL。
有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗? (填“可行”或“不可行”)
(3)将等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出可能是Cu2+浓度不同引起的,你同意这种看法吗?
(填“同意”或“不同意”),原因是 。
另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否,请简述实验方案、实验现象及由此得出的结论: 。
22.(8分)
已知当溶液的pH在10左右时,铝元素主要以Al(OH)3形式存在。如果饮用水中含有
一定浓度的NO3-将对人体健康产生危害,NO3-能氧化人体血红蛋白中的Fe(Ⅱ)使其失去携氧功能:NO3-还能被水中还原性物质还原成具有强烈致癌作用的NO2-。为此世界卫生组织规定饮用水中NO3-含量(以N计)必须小于10mg·L-1。为降低饮用水中NO3-的浓度,某研究人员提出以下3种方案:
a. 微碱性条件下用Fe2+ 还原,还原产物为NH3。
b. pH=10.25时,用铝粉还原,NO3-的还原产物主要为N2。
c. 在催化剂作用下用氢气还原,还原产物主要为N2。
(1)a方案中的一种产物还有净水作用,这种物质是 。(请填写化学式)
(2)b方案中最好用 调节pH 。
A.NaOH B.CaO C.NH3·H2O
理由是 。
(3)与a、b方案相比,c方案的优点是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com