
9.下列叙述正确的是 ( )
A.大量使用含磷洗涤剂会带来白色污染
B.减少使用氟氯代烷的目的是为了减少酸雨
C.硫酸厂产生的污水含有硫酸等杂质,可用石灰乳中和处理
D.钢铁在潮湿空气中易生锈,是因为发生了化学腐蚀
|
A.化学变化不产生新元素,产生新元素的变化不是化学变化
B.根据分散质微粒直径大小可以将分散系分为溶液、浊液和胶体
C.标准状况下,22.4LCO2与CO的混合气体中含有的碳原子数为NA
D.某微粒的电子数等于质子数,则该微粒可能是一种分子和一种离子
29.(12分)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有离子交换膜(只允许阳离子通过),其工作原理如下图所示。(电极均为惰性电极)

(1)该电解槽的阳极反应式是 。
(2)通电开始后,阴极附近溶液pH会增大,请简述原因 。
(3)除去杂质后的氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
28.(11分)实验室用下列方法测定某水样中O2的含量。
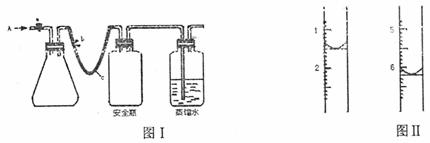
(1)用如图I所示装置,使水中溶解的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为 。
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是 。
②用注射器抽取20.00mL某水样从A处注入锥形瓶。
③再分别从A处注入含m mol NaOH的溶液及过量的MnSO4溶液
④完成上述操作后,下面应进行的操作是 。
(2)用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为:
MnO(OH)2+2I-+4H+=Mn2++I2+3H2O。实验步骤:
⑤打开止水夹a和b,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸溶液。⑥重复④的操作。
(3)用Na2S2O3标准溶液滴定步骤(2)中生成的I2,反应方程为:
I2+2Na2S2O3 = 2NaI+Na2S4O6。实验步骤:
⑦取下锥形瓶,向其中加入2~3滴 作指示剂。
⑧用0.005mol/L Na2S2O3滴定至终点。
(4)计算。滴定过程中,滴定前后滴定管中的液面读数如图II所示。
⑨经计算,此水样中氧(O2)的含量为 g/L。
27.(18分)已知:2CH3COOH(足量)+CO2-3=2CH3COO-+CO2+H2O。现有下列电解质溶液;①Na2CO3②NaOH③NaHCO3④CH3COONa⑤FeCl3⑥Kal(SO4)2
(1)当(1)~(4)四种溶液的pH相同时,其物质的量浓度由大到小的顺序是 。
(2)将浓度均为0.2mol/L的①~④四种溶液,稀释相同倍数,pH变化最大的是 。
(3)常温下,pH都等于11的①和②中,由水电离出的c(OH-)分别是 mol/L
和 mol/L。
(4)⑥可用做净水是因为
有关的反应的离子方程式是 。
26. (19分)t℃时,将2mol A和1mol B通入体积为2L的密闭容器中(容积不变),发生如下反应,2A(g) + B(g) xC(g),2分钟后反应达到平衡状态 ,剩余了0.8molB,并测得C的浓度是0.3mol/L。请填写下列空白:
(19分)t℃时,将2mol A和1mol B通入体积为2L的密闭容器中(容积不变),发生如下反应,2A(g) + B(g) xC(g),2分钟后反应达到平衡状态 ,剩余了0.8molB,并测得C的浓度是0.3mol/L。请填写下列空白:
(1)从反应开始至平衡状态,A的平均反应速率为 。
(2)x=
(3)若向容器中通入少量氦气(假设氦气和A、B、C都不反应),化学平衡(填字母) 。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)若向原平衡混合物的容器中再充入amol C,在t℃下达到新的平衡,此时B的物质的量为:n(B)= mol。
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,则起始加入三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 。
13.25℃、101Pa时,下列与反应热有关的叙述正确的是 ( )
A.已知碳的燃料热是393.5kJ/mol,则C(s)+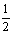 O2(g)=CO(g);△H=-393.5kJ/mol
O2(g)=CO(g);△H=-393.5kJ/mol
B.已知强酸和强碱的中和热是57.3kJ/mol,则H+(aq)+OH-(aq)=H2O(l);△H=+57.3kJ/mol
 C.已知N2(g)+3H2(g)
2NH3(g);△H=-92.2kJ/mol,上式中的化学计量数表示的是分子个数
C.已知N2(g)+3H2(g)
2NH3(g);△H=-92.2kJ/mol,上式中的化学计量数表示的是分子个数
 D.已知2SO2(g)+O2(g) 2SO3(g);△H=-196.6kJ/mol,则将2mol SO2和1mol O2充入装有合适催化剂的密闭容器中,充分反应达平衡后放出的热量一定小于196.6kJ
D.已知2SO2(g)+O2(g) 2SO3(g);△H=-196.6kJ/mol,则将2mol SO2和1mol O2充入装有合适催化剂的密闭容器中,充分反应达平衡后放出的热量一定小于196.6kJ
第Ⅱ卷
12.将0.1L含有0.02mol CuSO4和0.01mol NaCl的水溶液用惰性电极电解。电解一段时间后,一个电极上得到0.01mol Cu,则另一电极析出的气体 ( )
A.只有Cl2 B.只有O2 C.既有Cl2又有O2 D.只有H2
11.若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是:Cu+2H+=Cu2++H2↑,则下列关于该装置的有关说法正确的是 ( )
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,且金属铜为该电解池的阳极
D.该装置只能是原电池,电解质溶液不可能是盐酸
9.物质的量浓度都是0.1mol·L-1的HX与NaX溶液等体积混合后,溶液中粒子浓度的关系错误的是 ( )
A.c(Na+)+ c (H+)= c(X-)+ c (OH-)
B.c(X-)+ c(HX)=2 c(Na+)
C.若混合溶液呈碱性则c(Na+)> c(HX)> c(X-)> c (OH-)> c (H+)
D.若混合溶液呈酸性则c(X-)> c(Na+)> c(HX)> c (H+)> c (OH-)
|
A.0.01mol·L-1的CH3COOH溶液 B.0.01mol·L-1的HNO3溶液
C.pH=2的H2SO4溶液 D.pH=2的CH3COOH溶液
8.某温度下,关于pH=3的盐酸和pH=3的醋酸的对比正确的是 ( )
A.盐酸的导电能力比醋酸强
B.完全中和等体积的两种酸,醋酸消耗的氢氧化钠比盐酸多
C.同时稀释103倍后,两溶液的pH仍相等
D.升高相同温度,两溶液中由水电离出的OH-浓度相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com