
13.向10mL某浓度的盐酸中逐滴加入0.1 mol/L氨水,溶液的pH与加入的氨水的体积关系曲线如图所示,下列各项中正确的是( )

A.盐酸的浓度为1mol/L
B.在B点:c(NH4+)=c(Cl-)>c(OH-)=c(H+),且a>10
C.在A、B间任意一点:c(Cl-)>c(NH4+)> c(H+)> c(OH-)
D.在C点:c(NH4+)>c(Cl-)> c(H+) > c(OH-)
非选择题:(非选择题:共10小题,共174分)
12.在很多晚会上,热情的观众都会手持闪闪发光的各色“魔棒”,魔棒发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光。草酸二酯的结构简式如图所示, 下列说法中不正确的是 ( )
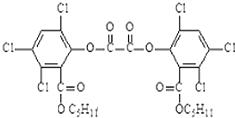
A.草酸二酯属于芳香族化合物
B.草酸二酯的分子式为C26H24O8Cl6
C.草酸二酯难溶于水
D.草酸二酯水解能生成2种有机产物
11. NA为阿伏加德罗常数,下列说法中正确的是 ( )
A. 17gNH4+中含有的电子数为10NA
B. 室温下,28g乙烯和丙烯的混合气体中含有的碳原子数为2NA
C. 标准状况下,22.4LSO3所含的分子数为NA
D. 1mol/L Mg(NO3)2溶液中含有NO3-的数目为2NA
9.根据实验现象所作的结论一定正确的是 ( )
A.无色试液 产生红色沉淀 结论:试液中有醛类物质
产生红色沉淀 结论:试液中有醛类物质
B.无色试液 产生白色沉淀 结论:试液中含有Ca(OH)2
产生白色沉淀 结论:试液中含有Ca(OH)2
C.无色试液 试液变红 结论:试液显碱性
试液变红 结论:试液显碱性
D.无色试液 产生白色沉淀 结论:试液中含有SO42-
产生白色沉淀 结论:试液中含有SO42-
|
A.1:3 B.3:1 C.5:2 D.2:5
8.某温度下,在容积固定不变的密闭容器中进行如下可逆反应:
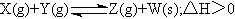
一段时间后,达到化学平衡状态。下列叙述正确的是 ( )
A.通入稀有气体,平衡向正反应方向移动
B.加入少量W,逆反应速率增大
C.升高温度,正反应速率增大,逆反应速率减小
D.降低温度,平衡向逆反应方向移动
7.下列反应的离子方程式书写正确的是 ( )
A.向苯酚钠溶液中通入少量

B.向FeCl3溶液中加入足量铜粉:2Fe3++3Cu=2Fe+3Cu2+
C.向FeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.向Ba(OH)2溶液中滴加少量稀硫酸:Ba2++OH-+H++
6.下列关系中不正确的是 ( )
A.熔点:SiO2 >NaCl >Na >H2O
B.稳定性:HF> NH3 >PH4 >SiH4
C.半径:F->Na+ >Li+>H-
D.沸点:正己烷>正戊烷>异戊烷>新戊烷
27.某温度下,向10L真空容器中注入1.00mol H2(g) 和1.00mol I2(g),反应平衡后溶度为0.0200mol/L。
 (1)试求:该温度下H2(g) + I2(g) 2HI(g) 的H2的平衡转化率。
(1)试求:该温度下H2(g) + I2(g) 2HI(g) 的H2的平衡转化率。
(2)若开始加入2.00mol H2(g) 和I2(g),试求达到平衡时生成HI的物质的量。
26.50mL0.50mol/L盐酸与50mL0.50mol/L氢氧化钠溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可以计算中和热。回答下列问题:

(1)烧杯间填满泡沫塑料的作用是 ;
(2)大烧杯上如不盖硬纸板,求得中和热(所放出热量)的数值 (填“偏大、偏小或无影响”,下同); 若用50mL18mol/L硫酸代替盐酸进行实验,所放出 的热量会 ;
(3)实验中若改用60mL0.50mol/L盐酸与50mL0.55mol/L氢氧化钠溶液进行反应,与上述实验相比,所放出的热量 (填“相等或不相等”);
(4)经计算,此实验中反应放出热量1.25kJ , 则中和热等于
(5)第4题的计算结果往往比真实值小,试分析可能的原因。(写出两条)
25.根据下列某些共价键的键能回答下列问题:
|

(1)根据表格中的键能数据分析,为什么氮气和氧气一般要在放电条件下进行,而氢气只要点燃就能在空气中燃烧: _____________________________ ______。
(2)分析表格中有关共价键的键能变化规律,估计H-S键键能x的可能范围:
。
(3)根据表中数据,写出“H2+O2”反应的热化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com