
12.常温下,由两种不同的饱和气态链烃(碳原子数≤4)分子组成的某混合气体,若取1mol该混合物与O2完全反应生成CO2和H2O,消耗氧气4.25mol。则此混合物的可能组合的方式最多有 ( )
A.3种 B.4种 C.5种 D.6种
11.金属钾的冶炼可采用如下方法: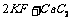 ========
========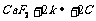 。下列有关说法合理的是 ( )
。下列有关说法合理的是 ( )
A.当转移1mol 电子时,生成39g K
B.该反应能说明C的还原性大于K
C.该反应的氧化剂是KF,氧化产物是K
D.CaC2、CaF2均为离子化合物,且阴、阳离子个数比均为2∶1
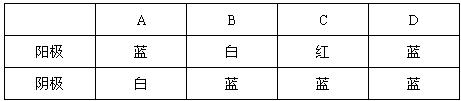
9.将一直流电源的正、负极(电极材料为Pt),用玻璃片分别压在一张用食盐水、碘化钾、淀粉溶液和石蕊试液浸透的滤纸上,经过一段时间后,两极附近滤纸的颜色分别是( )
|
A.反应中放出的气体在标准状况下的体积为1.12L
B.稀释、定容操作中用到的全部玻璃仪器有:烧杯、胶头滴管及500mL容量瓶
C.所得 溶液中和
溶液中和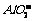 的个数之比一定为1∶1
的个数之比一定为1∶1
D.整个反应过程中共转移电子0.4mol
8.某溶液中大量存在的五种离子: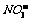 、
、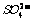 、
、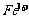 、
、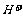 、M(M代表一种离子),其物质的量之比为:
、M(M代表一种离子),其物质的量之比为: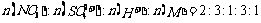 则M可能为 ( )
则M可能为 ( )
A.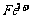 B.
B.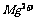 C.
C.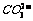 D.Cl-1
D.Cl-1
7.在元素周期表的短周期元素中,原子电子层数与最外层电子数之比为1∶1、2∶1的元素共有 ( )
A.4种 B.5种 C.6种 D.7种
6.“绿色能源”是目前正在研究的新能源之一,高粱、玉米等绿色植物的种子经发酵、蒸馏就可以得到“绿色能源”中的一种,这种物质是 ( )
A.氢气 B.甲烷 C.酒精 D.木炭
29.(15分)芳香族化合物水杨酸(C7H6O3)是一种消毒防腐药,有溶解皮肤角质的作用,用于局部角质增生及皮肤霉菌感染等的外用治疗。它可以和NaHCO3溶液反应。化合物B中含有一个苯环和一个七元环,B在稀H2SO4存在下可以水解生成水杨酸和A,其转化关系如下:
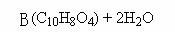

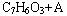
A和浓硫酸共热有两种主要产物C、D生成,如下图所示:
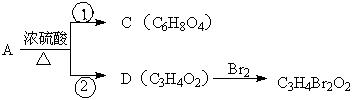
请回答下列问题:
(1)水杨酸的结构简式为 ;它的符合下列条件的同分异构体有
种。
①能发生银镜反应
②遇FeCl3溶液显紫色
③苯环上的一溴代物只有两种
(2)关于水杨酸性质的下列说法中不正确的是( )
A.具有酸性 B.能使溴水褪色
C.该分子所有原子不可能共面 D.能发生酯化反应
(3) D的结构简式 ,②的反应类型 。
(4)反应①的化学方程式 。
28.(15分) 某化学课外活动小组为探究铜与硝酸反应还原产物主要生成NO时硝酸的浓度,设计实验装置如下图所示:(连接好仪器并检查气密性后,分别装入相对应的试剂)
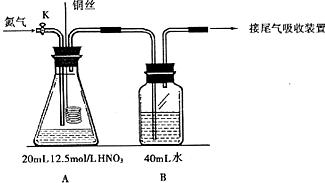
Ⅰ.(1)实验开始前先打开活塞K持续通入N2一段时间后,关闭K。将铜丝(足量)下移伸入浓硝酸中,有大量的红棕色气体生成,随时间的进行,气体颜色变浅,当A中充满无色气体时:
①装置A中的离子方程式为:________________________________
②接下来的实验操作是: _______________________________________
(2)本实验中装置A的优点是: ___________________________________
Ⅱ. 将B中溶液稀释至200mL,用0.20mol/L的NaOH溶液进行滴定。实验数据如下(硝酸的挥发分解及体积的变化忽略不计)。
|
实验编号 |
待测液体积(mL) |
NaOH溶液体积(mL) |
|
1 |
20.00 |
15.98 |
|
2 |
20.00 |
14.99 |
|
3 |
20.00 |
15.01 |
(1)待测液的浓度为:_____________ mol/L
(2)硝酸与铜反应主要生成NO时硝酸的浓度不大于 __________ mol/L
27.A、B、C、D为中学化学常见的物质,其组成元素均为主族元素。它们间的反应关系如下图所示。[除(1)外,反应均在常温下进行]
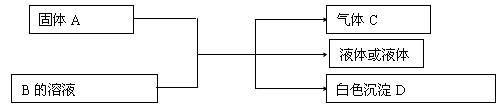
(1)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则A与B共热的化学方程式为 。
(2)若A是碳化钙(CaC2),B是一种盐,A与B的溶液反应时只生成气体C、CaCO3和水;则B的化学式为 ;C分子是由 分子(填“极性”或“非极性”),所含共价键的类型为 ___________。
(3)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液,A的相对分子质量与D相同。向一定量的B溶液中逐渐加入固体粉末A,当 A与B以物质的量之比3∶1反应时,生成的D的量最多。则A的化学式为 , B的化学式为 。
26.(15分) X、Y、Z、W为短周期元素形成的粒子,它们的电子数相等。已知X为负二价双原子阴离子;Y为双原子分子;Z在常温下为液体,其水溶液显弱酸性;W是由极性键和非极性键构成的六原子分子。
(1)X与Na+组成的离子化合物常温下跟水反应产生一种可助燃的气体,该反应的化学方程式为_____________________________________________________。
(2)若Y为遇水就剧烈反应的单质,则Y的电子式为________________;若Y为化合物,用石墨电极电解Y的水溶液,其电解总反应式为______________________。
(3)在淀粉KI溶液中滴加Z的水溶液,溶液变蓝,其原因可用离子反应方程式表示为
_____________________________________。
(4)在最初载人飞船的火箭推进器中,一般采用Z和W两种液态化合物,当它们混合反应时生成氮气和一种常见液态氧化物。已知16g W反应时放热409.6 kJ,则Z和W反应的热化学方程式为_________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com