
(三)制备红色物质:方法同初中课本
(二)查阅资料:①Cu2+在酸性条件下能发生自身氧化还原反应(Cu2O+2H+ =Cu2++Cu+H2O);②在空气中灼烧Cu2O能生成CuO。
(一)提出猜想:红色物质可能是铜、氧化亚铜或两者的混合物。
10.下列说法中不正确的是 ( )
A.乙烷、乙醇和乙酸都能发生取代反应
B.苯分子中没有乙烯分子中的双键结构,因此苯不能发生加成反应
C.可用新制的Cu(OH)2悬浊液检验患者的尿液中是否含糖
D.蛋白质溶液中加入饱和(NH4)2SO4溶液后蛋白质会析出,再加水可溶解
11.同温同压下,下列各热化学方程式中反应热数值最小的是 ( )
A.2A(l)+B(l)=2C(g) △H=+Q1kJ·mol-1
B.2A(g)+B(g)=2C(g) △H=+Q2kJ·mol-1
C.2A(g)+B(g)=2C(l) △H=+Q3kJ·mol-1
D.2A(l)+B(l)=2C(l) △H=+Q4kJ·mol-1
12.下列说法中正确的是 ( )
A.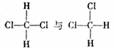 互为同分异构体
互为同分异构体
B.HF、HCl、HBr、HI的热稳定性依次增强
C.升高饱和石灰水的温度时,Ca(OH)2的溶度积常数Ksp减小
D.常温下,pH=1的溶液中,Ba2+、Na+、I-、NO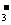 可以大量共存
可以大量共存
13.某溶液中只有Na+、CH3COO-、H+、OH-四种离子,且浓度大小的顺序为:
c(CH3COO-)>c(Na+)>c(H+)>c(OH- ) ,下列说法正确的是 ( )
A.该溶液由pH =3的CH3COOH与pH =11的NaOH溶液等体积混合而成
B.在该溶液中加入适量的CH3COONa,可使溶液中离子浓度大小顺序改变为:
c(Na+)> c(CH3COO-) >c(H+)>c(OH- )
C.在该溶液中加入适量NaOH,可使溶液中离子浓度大小改变为:
c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.由0.1 mol/L的CH3COOH与0.1 mol/L等体积的NaOH溶液混合而成
14.X、Y、Z为短周期元素,Z的原子序数等于X、Y的原子序数之和,且Z离子比X离子多三个电子层,下列推断不正确的是 ( )
A.Y的原子半径大于Z的原子半径 B.X可能为金属元素
C.Y与Z不可能形成离子化合物 D.Z一定为非金属元素
15.已知氯化铁溶液能与碘化钾反应生成氯化亚铁、氯化钾和碘单质。某溶液中含有的溶质是FeBr2、FeI2,若向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变成血红色。则下列叙述正确的是 ( )
①原溶液的Br-一定被氧化; ②通入氯气后溶液中的Fe2+一定被氧化; ③不能确定通入氯气之后的溶液中是否存在Fe2+; ④若取少量所得溶液,再加入CCl4充分振荡后静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的Fe2+、Br-、I-均被完全氧化。
A.只有②③ B.①②③④ C.只有①④ D.只有②③④
|
[必做部分]
28.(12分)已知NO2和N2O4可以相互转化:N2O4(g) 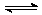 2NO2(g) △H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如下图所示:
2NO2(g) △H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如下图所示:
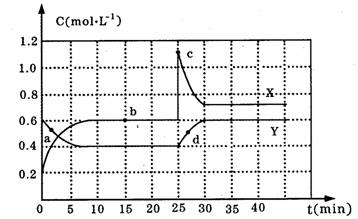
请回答下列问题:
(1)图中共有两条曲线X和Y,其中表示N2O4浓度随时间变化的曲线是 ;
(2)前10min内,v(N2O4)= ;
(3)a、b、c、d四个点中,表示化学反应处于平衡状态的是 ,此时反应的平衡常数为 ;
(4)反应进行到25min时,曲线发生变化的原因是 ;若要达到最后相同的化学平衡状态,在25min时还可以采取的措施是 (填序号)。
A.升高温度 B.缩小容器体积 C.加入催化剂 D.加入一定量的N2O4
29.(13分)有A、B、C三种短周期元素,它们的原子序数依次增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素原子最外层电子数比B元素原子最外层电子数多一个。甲、乙、丙依次是A、B、C三元素最高价含氧酸的钠盐,甲、乙溶液pH>7,丙溶液pH<7;丁为气体,戊为淡黄色固体。
甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图(部分产物已略去):
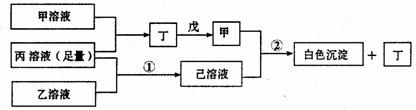
(1)A的元素名称为 ,C元素的简单离子结构示意图为 ;
(2)写出反应①的离子方程式 ;
(3)甲溶液中所有离子的浓度由大到小的顺序为 ;
(4)将两个铜电极插入丙溶液中进行电解,开始时发生的离子方程式为 ;
(5)写出反应②的化学方程式 。
30.(17分)铜有Cu2O(红色)和CuO(黑色)两种常见的氧化物。某高中化学兴趣小组的同学对初中课本实验的结论“H2与CuO反应生成红色物质Cu”提出质疑,认为生成的红色物质不一定就是铜。为了确定该红色物质的成分,该兴趣小组开展了以下研究。
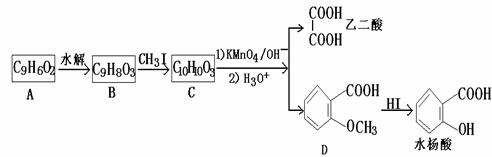
29.(16分)香豆素是广泛存在于植物中的一类芳香族化合物,大多具有光敏性,有的还具 有抗菌和消炎作用。它的核心结构是芳香内酯A,其分子式为C9H6O2,该芳香内酯A经下列步骤转变为水杨酸和乙二酸。
提示:①CH3CH=CHCH2CH3 CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
②R-CH=CH2 R-CH2-CH2-Br
R-CH2-CH2-Br
请回答下列问题:
(1)写出化合物C的结构简式 。
(2)化合物D有多种同分异构体,其中一类同分异构体是苯的二取代物,且水解后生成的产物之一能发生银镜反应。这类同分异构体共有 种。
(3)在上述转化过程中,反应步骤B→C的目的是 该反应的反应类型是 。
(4)请设计合理方案从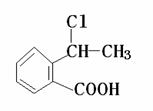 合成
合成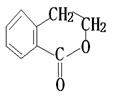 (要求四步完成,用反应流程图表示,并注明反应条件)
(要求四步完成,用反应流程图表示,并注明反应条件)
例:由乙醇合成乙烯的反应流程图可表示为
CH3CH2OH CH2=CH2
CH2=CH2
 CH2-CH2
CH2-CH2

28.(18分)下图是某实验室测定黄铁矿(主要为FeS2)中硫元素的质量分数的装置:
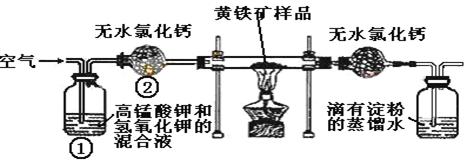
实验时有如下操作:
A.将瓷管中样品加热到800℃~850℃
B.称取研细的黄铁矿样品
C.连接好全部仪器,并检查其气密性
D.将样品小心放入硬质瓷管中部
E.以均匀的速度不断鼓入空气
F.用标准碘溶液滴定含淀粉SO2水溶液
(1)正确的实验步骤的次序是(以A、B……的序号表示)
(2)写出黄铁矿煅烧的化学方程式 ;
(3)装置①的作用是___________________________________________;
装置②的作用是_________________________________________。
(4)碘跟SO2水溶液反应的离子方程式为__________________________。
(5)根据______________________现象判断滴定已达到终点。
(6)若称得矿样的质量为0.0900g,滴定管中碘溶液的初读数为1.10mL,末读数为25.60mL,标准碘溶液的浓度为0.0500mol/L,则该黄铁矿样品中硫元素的质量分数为________________________。(假定实验过程中硫元素无损失)
27.(10分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验 编号 |
HA物质的量浓度 (mol/L) |
NaOH物质的量浓度 (mol/L) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
C1 |
0.2 |
pH=7 |
|
丙 |
0.1 |
0.1 |
pH>7 |
请回答下列问题:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸 ;
(2)不考虑其它组的实验结果,但从乙组情况分析,混合溶液中离子浓度c(A-)与c(Na+)的大小关系是 ;
A.前者大 B.后者大 C.相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
26.(16分)A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体,E是地壳中含量居第二位的金属。D可分别跟A、B、C在一定的条件下化合,生成X、Y、Z;Y、Z与Ne的电子数相等,Z能使湿润的红色石蕊试纸变蓝色,A是第三周期的元素。有关的转化关系如下图所示(反应条件均已略去):
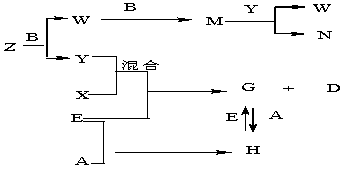
(1)E元素在周期表中的位置 。
(2)A的化学式为_________,Z的电子式为_________。
(3)Z与X反应后产生的物质晶体类型是 。
(4)Z和W在催化剂的作用下反应生成C和Y,这是一个很有意义的反应,可以消除W对环境的污染,该反应的化学方程式为______________________。
(5)将N溶液慢慢滴入G的溶液中会产生W,写出上述变化的离子反应方程式__________________。
(6)Z与N恰好反应后产物溶解在水中,所得溶液的pH(填“大于”或“小于”)____________7,用离子反应方程式表示其原因为_____________________。
13.一定条件下,体积为5L的密闭容器中,0.5molX和0.5molY进行反应:
2X(g)+Y(g) 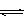 Z(g),经60s达到平衡,生成0.15molZ。下列说法正确的是( )
Z(g),经60s达到平衡,生成0.15molZ。下列说法正确的是( )
A.将容器体积变为10L,Z的平衡浓度变为原来的1/2
B.以Y浓度变化表示的反应速率为0.0005mol·L-1·s-1
C.若增大压强,则物质Y的转化率减小
D.若降低温度,X的体积分数增大,则该反应的△H<0
第Ⅱ卷(非选择题共174分)
|
请用0.5毫米黑色墨水签字笔在答题卡上书写作答,在试题卷上书写作答无效。
12.LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠。已知该电池放电时的电极反应式为: FePO4+Li++e-=LiFePO4 ;Li-e-= Li+。下列说法中正确的是
( )
A.锂离子动力电池的负极为还原反应
B.充电时,锂离子动力电池的阴极反应为 Li+ + e- = Li
C.放电时电池内部Li+ 向负极移动
D.放电时,在正极上是Li+得电子被还原
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com