
7、 下列事实与氢键有关的是
A.水加热到很高的温度都难以分解
B.水结冰成体积膨胀,密度减少 C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高 D.HF、HCl、HBr、HI的热稳定性依次减弱
6、高温超导材料中铊是成分之一,铊是铝的同族元素,关于铊的性质判断错误的是
A.铊是银白色的金属 B.铊能形成+3价的化合物
C.铊能与硝酸反应 D.Tl(OH)3具有两性
5、按周期表中碱金属元素从上到下的顺序,下列描述错误的是
A.原子最外层电子数逐渐增多 B.原子电子层数逐渐增多
C.失去电子能力逐渐增强 D.金属性逐渐增强
4、下列各微粒中, 核外电子总数相等的是:
A.Na和Na+ B.N2 和 CO2
C.NH4+ 和 H3O+ D.H2S 和 H2O
3、下列物质中含有非极性键的化合物是
A.NaOH B.Na2O2 C.Cl2 D.CO2
2、下列对16O和18O的叙述正确的是
A.核内质子数均为6 B.核内均含有8个中子
C.互为同位素 D.都是氧的同素异形体
1、1999年是人造元素丰收年,一年间得到了核电荷数分别为114、116、118三种新元素。已知核电荷数为118的新元素的一种原子的质量数为293,则该原子里中子数与电子数之差为
A.0 B.57 C.118 D.175
29.(12分)向密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示。乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t3-t4阶段为使用催化剂(已知t0-t1阶段c(B)未画出)
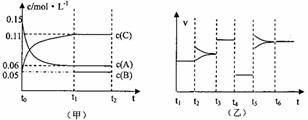
(1)若t1=15s,则t0-t1阶段以C浓度变化表示的反应速率v(C)为= 。
(2)若t2-t3阶段,C的体积分数变小,此阶段v(正) v(逆)(填“>”“<”“=”)
(3)t4-t5阶段改变的条件为 ,B的起始物质量为 。
(4)t5-t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为akJ,写出该反应的热化学方程式 。
28.(18分)已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:居室中甲醛含量不得超过0.08 mg/m3。可利用酸性高锰酸钾溶液测定甲醛含量。
测定原理:KMnO4(H )溶液为强氧化剂,可氧化甲醛和草酸。
)溶液为强氧化剂,可氧化甲醛和草酸。
有关离子方程式为:
4MnO4-+5HCHO+12H+==4Mn2+ +5CO2↑+11H2O
2 MnO4-+5H2C2O4+6H+==2Mn2+ +10CO2↑+8H2O
测定装置:部分装置如图所示(a、b为止水夹)。
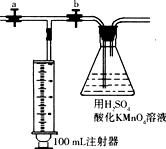
测定步骤:
①收集待检新装修的房屋居室空气5 L。
②用 准确量取5.00 mL 1.00×10-3 mol/L的高锰酸钾溶液于250 mL锥形瓶中,滴入3滴6 mol/L的H2SO4溶液,加水45 mL稀释,备用。
③将1.00×10-3mol/L的草酸标准溶液置于 滴定管中备用。
④ (填操作),用注射器抽取100 mL新装修的房屋的室内空气。 (填操作),再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次。
⑤用标准草酸溶液滴定锥形瓶中的溶液,记录滴定所消耗的草酸溶液的体积。
⑥再重复实验2次(每次所取的高锰酸钾溶液均为5.00 mL)。3次实验所消耗草酸溶液的体积平均值为12.45mL。
回答以下问题:
(1)将“测定步骤”中的空格填上
② ③ ④ ;
(2)如果注射器压送气体速度过快,可能会产生什么不良后果?
(3)本实验是否需要外加指示剂?若需要请指出指示剂的名称,若不需要,试说明如何确定滴定的终点。
(4)计算该居室内空气中甲醛的浓度_________mg/m3,该居室的甲醛________.(填“是”或“否”)超标。
27.(16分)在磷的催化作用下,羧酸可以和卤素反应生成α-卤代酸,例如:
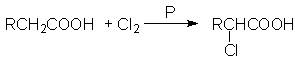
根据以下各步反应的条件和最终产物的分子式,试
(1)推断物质A 、C 、F 、H 的结构简式。
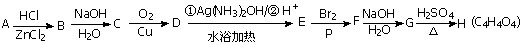
A C F H
(2)写出D与Ag(NH3)2OH溶液反应的化学方程式
(3)近年来,化石燃料短缺,价格上涨,世界各国都在积极寻求替代品。在上述A-H化合物中,最适合用作燃料的是 (填结构简式),理由是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com