
23.(11分)
重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐。工业上一般采用高温煅烧还原法;实验室可以采用沉淀转化法。
●高温煅烧还原法
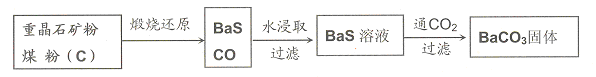
(1)煅烧还原的热化学方程式为:
有关的数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H= -1473.2 kJ·mol-1
C(s)+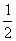 O2(g)=CO(g);△H= -110.5 kJ·mol-1
O2(g)=CO(g);△H= -110.5 kJ·mol-1
Ba(s)+S(s)=BaS(s);△H= -460kJ·mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)
●沉淀转化法
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液。如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32―(aq) BaCO3(s)+SO42―(aq)(平衡常数K=0.042)
BaCO3(s)+SO42―(aq)(平衡常数K=0.042)
(3)现有0.20 mol BaSO4,每次用1.00 L 2.0mol·L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是
22.(12分)
红钒钠(重铬酸钠:Na2Cr2O7·2H2O,橙红色晶体)是重要的化工原料。工业铬铁矿(FeO·Cr2O3,含少量Al2O3和SiO2)按以下过程来制取红钒钠。
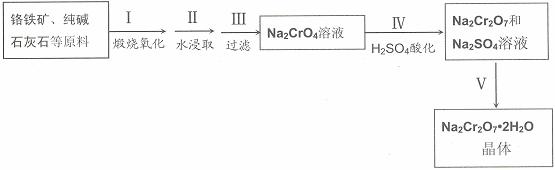
(1)步骤I的反应有:4 FeO·Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2,生成1mol Na2CrO4转移的电子数为 mol;原料中加入CaCO3的作用是
A.分解产生CaO,与某些杂质反应形成炉渣
B.分解时放出大量热量,提高煅烧温度
C.分解产生CO2从下而上穿过,使得炉料翻滚,加快原料的煅烧氧化
(2)浸取液中含有铝和硅的化合物,步骤III过滤前要用稀H2SO4将浸取液的pH调至7-8,并煮沸除去铝和硅的化合物,其离子方程式为:
(3)步骤IV反应为:2CrO42-+2H+= Cr2O72-+H2O,平衡常数表达式为:K=
下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线:

(4)据此,步骤V操作的方法是:将IV所得溶液 (填操作),趁热过滤得到的晶体是 (填化学式);然后将所得溶液 (填操作),得到的晶体是 。
21.(12分)
某混合金属粉末,除Mg外还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。
所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O
该小组探究过程如下:
●查阅资料:
|
①镁、铝、锌都是白色金属; ②锌(Zn)可以与NaOH溶液反应生成H2; ③Zn(OH)2白色固体,难溶于水,可溶于强碱及NH3·H2O; ④Zn2+易形成络合物如[Zn(NH3)4] 2+,该络合物遇强酸分解生成Zn2+、NH4+。 |
●提出假设:
(1)假设1:该混合金属粉末中除镁外还含有 元素
(2)假设2:该混合金属粉末中除镁外还含有 元素
假设3:该混合金属粉末中除镁外还含有铝、锌元素
●实验探究:
甲同学基于假设3设计实验方案如下:
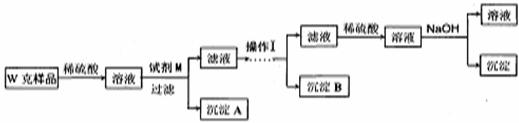
乙同学同样基于假设3设计另一实验方案如下:
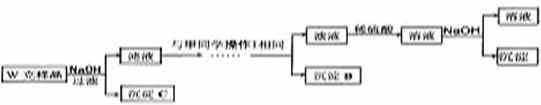
(3)试剂M是
(4)写出操作I的过程
(5)丙同学认为乙同学的方案比甲同学的好,理由是
(6)丁同学研究了甲、乙两同学的方案后,用最简便的方法测定了Wg样品中金属镁(Mg)的质量分数,他的方法是
19(10分)
碱式碳酸镁和无水氯化镁具有广泛的用途。
●用白云石(CaCO3·MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如下:

回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有:
(2)从MgCl2晶体得到无水MgCl2的操作为:
●为探究所制得的水合碱式碳酸镁(m MgCO3·n Mg(OH)2·x H2O)的组成。某同学组装仪器如图所示:
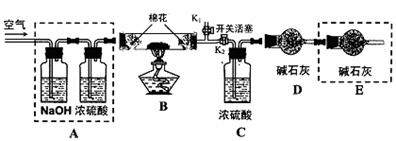
(3)实验测得:硬质玻璃管中剩余的固体质量为1.60g,C处浓H2SO4增重0.72g,D处碱石灰增重1.32g,此水合碱式碳酸镁的化学式为:
(4)A框中装置的作用是 ;在装好试剂后,加热前应进行的操作是 。
(5)若将E框中的装置去掉,对实验结果的影响是 。
20.(12分)
某研究性学习小组探究溴的制备及提纯
●资料收集
|
溴 |
物理性质 |
暗红色液体,刺激性气味。室温下易挥发。熔点-7.2℃,沸点59.1℃。密度2.928g·cm-3。稍溶于冷水。 |
|
化学性质 |
溶于水生成次溴酸 |
●溴的制备
现只有下列试剂:溴化钾、MnO2、浓盐酸、稀硫酸、浓硫酸
(1)写出制取溴的化学方程式: 。
现只有下列仪器:(石棉网、导管、铁架台、塞子等略去)
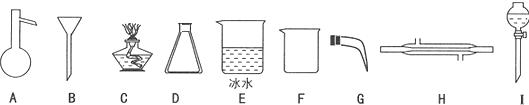
(2)根据反应原理,制备和收集溴应该选择的仪器有: (填字母序号)。
●溴的提纯
实验室用蒸馏法提纯液溴,装置如图所示。
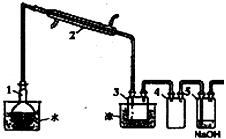
(3)蒸馏装置都用磨口玻璃器具,而不用橡胶管和橡胶塞连接,是因为
。
(4)装置4的作用是 。
(5)要想除去液溴中少量Cl2,可在液溴中加入 (填序号)后再分液分离即可。
①48%的氢溴酸 ②浓NaOH溶液 ③饱和KI溶液
18.反应N2O4(g) 2NO2(g);△H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g);△H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
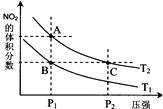
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
17.①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是( )
A.水电离的c(H+):①=②=③=④
B.将②、③溶液混合后,pH=7,消耗溶液的体积:②>③
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向溶液中加入100mL水后,溶液的pH:③>④>①>②
16.①0.1mol·L-1Na3PO4溶液中:c(Na+)=3c(PO43―)
②0.1mol·L-1Na2S溶液中:c(OH―)=c(H+)+c(HS―)+2c(H2S)
③0.1mol·L-1KHCO3溶液中:c(K+)>c(HCO3―)>c(OH―)>c(H+)
④只含有Na+、H+、Cl―、OH―的溶液中一定有:c(Cl―)=c(Na+)>c(H+)=c(OH―)
有关上述溶液的判断中,正确的一组是( )
A.①②③ B.③④ C.②③ D.②④
15.图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色色斑向d端扩散。下列判断正确的是( )
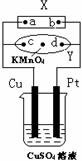
A.滤纸上c点附近会变红色
B.Cu电极质量减小,Pt电极质量增大
C.Z中溶液的pH先减小,后增大
D.Z溶液中SO42-向Cu电极定向移动
14.向恒温、恒容(2L)的密闭容器中充入2 mol SO2和一定量的O2,发生反应:
2SO2(g)+O2(g)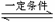 2SO3(g);△H= -197.74 kJ·mol-1,4min后达到平衡,这时c(SO2)=0.2mol
L-1,且SO2和O2的转化率相等。下列说法中,不正确的是( )
2SO3(g);△H= -197.74 kJ·mol-1,4min后达到平衡,这时c(SO2)=0.2mol
L-1,且SO2和O2的转化率相等。下列说法中,不正确的是( )
A.2min时,c(SO2)=0.6mol L-1
B.用O2表示4min内的反应速率为0.1mol·(L·min) -1
C.再向容器中充入1mol SO3,达到新平衡,n(SO2):n(SO3)=2:1
D.4min后,若升高温度,平衡向逆方向移动,平衡常数K增大
13.下列离子反应,表达正确的是( )
A.将NaOH固体加入热的浓NH4HSO3溶液中:NH4+ + OH― 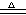 NH3↑+H2O
NH3↑+H2O
B.CaCO3与醋酸(CH3COOH)反应:CaCO3 +2H+=Ca2+ +CO2↑+H2O
C.向Fe2(SO4)3溶液中通入HI:2Fe3+ +2I―=2Fe2+ +I2
D.MgSO4溶液跟Ba(OH)2溶液反应:SO42― +Ba2+=BaSO4↓
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com