
12.下列操作中,能使电离平衡H2O H++OH-向右移动,且溶液呈酸性的是
( )
A.向水中加入NaHSO4溶液 B.向水中加入Al2(SO4)3溶液
C.向水中加入Na2CO3溶液 D.将水加热到100℃,使pH=6
11.由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生Cl2,下列有关混盐CaOCl2的判断正确的是 ( )
A.该混盐的水溶液呈中性 B.该混盐中氯元素的化合价为0
C.该混盐具有较强的氧化性 D.反应中产生1molCl2时转移2mol电子
10.对可逆反应:A(g)+B(g) C(s)+D(g);ΔH>0,右图所示为正逆反应速率(v)与时间(t)的关系,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤减少C,符合
|
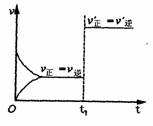
A.②③ B.①② C.③④ D.④⑤
9.用四种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是 ( )
|
选项 |
操作及现象 |
溶液 |
|
A |
通入SO2,红色溶液变为无色。加热溶液,又变为红色溶液 |
品红溶液 |
|
B |
通入SO2,红色溶液变为无色。继续通SO2至过量,溶液无明显变化 |
KMnO4溶液 |
|
C |
通入SO2,溶液变为红色。再加入足量的NaOH溶液,溶液变为紫色 |
紫色石蕊溶液 |
|
D |
通入SO2,溶液变浑浊,继续通SO2至过量,浑浊消失。再加入足量NaOH溶液,又变浑浊 |
饱和Ca(OH)2溶液 |
8.下列所叙述的实验操作中错误的是 ( )
(1)做银镜实验后,试管上附着物用氨水洗涤
(2)为了提高高锰酸钾的氧化性,用盐酸将其酸化
(3)用湿润的pH试纸测定某未知溶液的酸碱度
(4)中和滴定前,其滴定管应该用将要装入的同浓度的液体先润洗,但锥形瓶不必润洗
(5)在容量瓶内将NaOH溶解,以配制某浓度的NaOH溶液
A.(1)(2)(3) B.(1)(3) C.(1)(2)(3)(4)(5) D.(1)(2)(3)(5)
|
|
③乙烯的实验式C2H4 ④乙酸的结构简式CH3COH
⑤葡萄糖的结构简式C6H12O6 ⑥S2-的结构示意图为: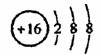
A.只有②⑥ B.只有③④ C.只有②③⑥ D.只有①③⑤
7.阿伏加德罗常数为NA,下列叙述正确的是 ( )
A.同温同压下,同体积的气体中所含的原子数必然相同
B.在1mol的CH3+(碳正离子)中,所含的电子数为10NA
C.31g白磷分子(P4)中含有P-P键数目为1.5NA
D.在标准状况下,22.4LSO3含有原子数为4NA
27.(10分)
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
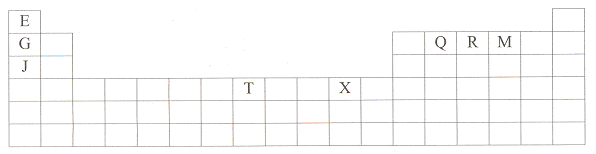
(1)T3+的核外电子排布式是:
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示)
(3)下列有关上述元素的说法中,正确的是: (填序号)
①G单质的熔点高于J单质,是因为G单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个 键
键
(4)加拿大天文台在太空发出了EQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键。写出其结构式:
(5)G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填G或R的元素符号)

26.(10分)、
香精(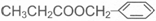 )在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其他两种有机物的路线如下:
)在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其他两种有机物的路线如下:
已知:①A只有两种一氯代物B和C
②
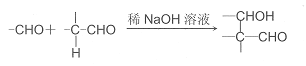
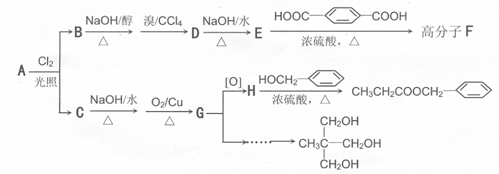
回答下列问题:
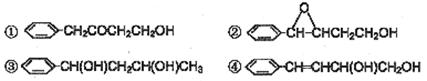
(1)和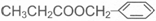 互为同分异构体的是:
(填序号)
互为同分异构体的是:
(填序号)
(2)D物质的名称为:
(3)由E合成F的化学方程式为: ;反应类型为
(4)工业用CH3CH2COONa和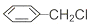 直接合成该香精,化学方程式为
直接合成该香精,化学方程式为
。
(5)以G和某种一元醛和必要的无机试剂为原料合成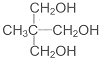 ,写出合成路线(注明条件,不要求写化学方程式)
。
,写出合成路线(注明条件,不要求写化学方程式)
。
25.(10分)
食品安全关系国民重生计,影响食品安全的因素很多。
(1)聚偏二氯乙烯(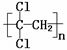 )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由 (写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由 (写结构简式)发生加聚反应生成的。
(2)劣质植物油中的亚油酸[CH3(CH2)4-CH=CH-CH2-CH=CH-(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是
A.分子式为C18H34O2 B.一定条件下能与甘油(丙三醇)发生酯化反应
C.能和NaOH溶液反应 D.能使酸性KMnO4溶液褪色
(3)假酒中甲醇(CH3OH)含量超标,请写出Na和甲醇反应的化学方程式:
(4)劣质奶粉中蛋白质含量很低。蛋白质水解的最终产物是 。
(5)在淀粉中加入吊白块制得的粉丝有毒。淀粉最终的水解产物是葡萄糖。请设计实验证明淀粉已经全部水解,写出操作、现象和结论:
24.(10分)
污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)-CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2 H2Dz Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式: 。萃取过程中要控制适宜的酸度。如果溶液的pH过大,其后果是 。
下图是用双硫腙(H2Dz)-CCl4络合萃取某些金属离子的酸度曲线。它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式被萃取分离的百分率。
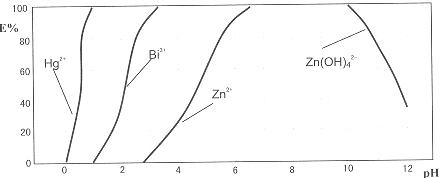
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)-CCl4络合萃取法处理废水。
请根据上图回答问题:
(2)欲完全将废水中的Hg2+分离出来,须控制溶液pH=
(3)当调节pH=2时,铋(Bi)的存在形式有: ,其物质的量之比为
(4)萃取到CCl4中的Zn(HDz)2分液后,加入足量的NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com