
5.下列说法不正确的是 ( )
A.为了减少白色污染,应控制塑料袋的使用
B.采用无氰电镀工艺是减少电镀污染的重要途径
C.研制开发燃料电池汽车,可减少机动车尾气污染
D.SO2、NO2或CO2都会导致酸雨的形成
29.(18分)近年来,我国科学家对有机物的“自由基”的研究有新的突破,在国际上占有领先的地位。有机物中常见的最简单的自由基是碳烯(:CH2),它十分活泼,很容易用它的两个未成对电子与不饱和烃反应,生成三碳环;也可以插在烷基的碳氢键(C-H)之间,使碳链增长。请回答下列问题:
⑴写出碳烯的电子式
⑵写出碳烯与丙烯反应产物的结构简式
⑶碳烯与烃A反应,生成烃B,一定量的B完全燃烧生成8.8g CO2和4.5g H2O,B分子中含有3个-CH3,且能完成下列转化关系:
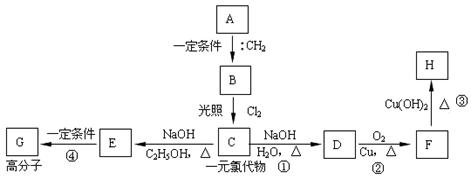
①写出A的结构简式 ,反应①的类型 ; ②写出反应③④的化学方程式: 反应③ ; 反应④ 。 ③H的同分异构体有多种,请写出能与NaOH溶液反应,但不与NaHCO3反应的同分异构体的结构简式 。
28.(16分)将硫酸亚铁晶体(FeSO4·7H2O)加入如图(I)中所示的干燥试管A里,隔绝空气加强热充分反应后,试管A中得残留固体甲,在试管B内得到无色液体乙。取出甲放在图(II)中的石英管C的中部,连接好其他部分的仪器后,开启旋塞K,逐滴滴加乙醇使C管左部石棉绒(一种纤维状硅酸盐材料,很稳定,不燃烧)浸润吸足,关闭K,然后加热,几分钟左右(加热过程中还可以较快地开启、关闭旋塞K来补充乙醇并使之通入石棉绒里),可观察到甲的颜色由红棕色逐渐变为黑色。反应停止后,取试管E中的液体0.5 mL逐滴加入到盛有配制的银氨溶液的试管F中,振荡后,把试管放在水浴中温热,不久试管内壁上附着一层光亮如镜的金属银。

回答下列问题: (1)写出如图(I)所示的干燥试管A中发生反应的化学方程式 ; (2)根据反应原理请你评价图(I)实验装置的主要缺点是 ; (3)试管C中反应的化学方程式为 ; (4)简述如何检验图(II)所示装置气密性 ; (5)试管D的作用是 ; (6)写出F试管中反应的化学方程式 。
27.(16分) A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质之间存在如下图所示转化关系(这些转化都不需要使用催化剂)。回答下列问题:
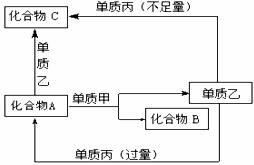
(1)若甲在转化中作还原剂,是常见金属,乙是常见非金属固态单质,且甲、乙、丙都由短周期元素组成,则A的结构式是 ,B的电子式是 ,A与甲反应的化学方程式是 。 (2)若甲在转化中作氧化剂,是常见非金属气态单质,丙是常见金属,甲、乙、丙中只有甲由短周期元素组成,乙与甲同主族、与丙同周期,乙也有强氧化性,且反应都在溶液中通常条件下进行,则: ①A与乙反应的离子方程式为 ; ②C与丙反应的离子方程式为 ; ③当A与甲的物质的量之比为2 :3时,A与甲恰好完全反应,且符合上图所示转化关系,则反应的离子方程式为 。
26.(10分)砷酸铅可用作杀虫剂。已知:①在砷酸铅中,砷处于最高价态,铅处于稳定价态;②砷酸铅是正砷酸对应的盐,1 mol正砷酸分子中含有8 mol原子。请回答以下问题: (1)砷元素在周期表中的位置 ;
(2)砷的最高价氧化物的化学式为 ;铅的最高价氧化物的化学式 为 ;
(3)砷酸铅的化学式为 ;
(4)砷酸铅能用作杀虫剂的原因可能是 。
12.我国科学工作者合成了许多结构复杂的天然有机化合物,如:叶绿素、血红素、维生素B等,叶绿素的分子结构如右图所示,下列有关叶绿素的说法中正确的是
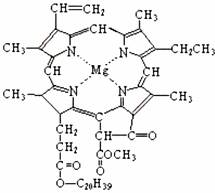
A. 叶绿素属于天然有机高分子化合物
B. 叶绿素分子中含有四种类型的双键
C. 叶绿素属于芳香烃
D. 在一定条件下,叶绿素能发生加成、水解、取代等反应
13.已知甲为恒温恒压容器,乙为恒温恒容容器。初始时,两容器的温度、体积相同,两容器中均充入2molSO2和lmolO2,且发生反应为2SO2(g)+O2(g) 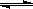 2SO3(g);△H<0,当两容器都达到平衡后,为使两者中的SO2在平衡混合物中的物质的量分数相同,下列措施中可行的是
2SO3(g);△H<0,当两容器都达到平衡后,为使两者中的SO2在平衡混合物中的物质的量分数相同,下列措施中可行的是
A.向甲容器中再充入一定量的氦气 B.向乙容器中再充入2mol的SO3气体 C.适当升高乙容器的温度 D.缩小甲容器的体积
11.某化学学习研究小组为确定一化工废液的成分,进行了如下实验操作:向少量样品废液中加入过量盐酸时有白色沉淀生成。过滤后,向滤液中加入过量氨水使溶液呈碱性时,有白色沉淀生成。过滤后,向滤液中加入小苏打溶液,又有白色沉淀生成。则该废液中可能含有的离子是 A. Ag+、Ca2+、Mg2+ B. AlO2-、Ba2+、Mg2+ C. Mg2+、Ag+、Na+ D. Ag+、Na+、Ba 2+
10.短周期元素中,若两种元素的原子序数相差8,则它们 A. 一定是同族元素 B. 周期数一定相差1 C. 只能形成1:1型化合物 D. 只能形成1: 2型化合物
9.实验桌上放有托盘天平、研钵、三脚架、泥三角、蒸发皿、坩埚、干燥器、酒精灯、火柴、烧杯、量筒100 mL、容量瓶、药匙、玻璃棒、石棉网、胶头滴管、坩埚钳。从缺乏仪器和用具的角度来看,不能进行的实验项目是
A. 配制0.1 mol / L 100 mL的CuSO4溶液 B. 蒸发
C. 测定硫酸铜晶体中结晶水的含量 D. 萃取 分液
8.在下列晶体结构示意图所表示的离子晶体中(●为阳离子,○为阴离子。以M代表阳离子,N代表阴离子),化学式为MN2的是
A. 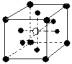 B.
B.
 C.
C.
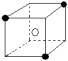 D.
D.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com