
28.(14分)氯气及氯的化合物有着广泛的应用。
(1)实验室用二氧化锰制氯气的化学方程式为___________________________________, 用上述药品制较多量氯气时,发生装置所需要的玻璃仪器主要包括
__________________________________________。
(2)已知氯气跟水的反应是可逆反应,写出氯气跟水反应的离子方程式。
____________________________________________________________________,结合上述离子方程式解释向氯水中加入NaHCO3固体后,氯水的杀菌、漂白能力增强的原因。________________________________________________________
____________________________________________________________________。
(3)我国卫生部已明确提出:要逐步用二氧化氯替代氯气进行饮用水的消毒。
① ClO2不稳定,可与NaOH溶液、H2O2反应,转化为比较稳定的亚氯酸钠(NaClO2)。该反应的化学方程式为
____________________________________________________________________。
② 用ClO2处理过的自来水中会残留ClO2,需要用FeCl2将其还原为Cl-。现用V L (已换算为标准状况)ClO2处理一定量自来水,再加入a mol FeCl2可将残留的ClO2恰好除去,则该自来水中残留ClO2的物质的量为____________________。
27.(16分)A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。
请针对以下三种不同情况回答:

(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
① A中含有的金属元素为_________________。
② 该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨及定向爆破,反应的化学反应方程式为_________________________________________________。
(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
①B的电子式为________________________________________________。
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为
____________________________________________________________。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①A中所含有的化学键是_______________、________________。
②将4.48 L(标准状况下)X通入100 mL3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为__________________________________________________。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为___________________。
26.(15分)X、Y、Z、M、W均为短周期非金属元素,其原子序数按由小到大排列。X
可分别与Y、Z、M组成10电子共价化合物,X与W可组成18电子共价化合物。X、Z、M三种元素可形成离子化合物。试回答:
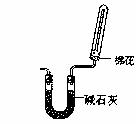

(1)X、Z、M三种元素组成的离子化合物的化学式为_________。
(2)实验室若用一种药品(气体发生装置不限)和右上图所示净化、收集装置制取ZX3,这种药品可能是___________________ 或_____________ _。
(3)用图所示装置完成实验。为使图中的两种气体在烧瓶中发生反应,首先打开弹簧夹a(弹簧夹b已处于关闭状态),未见明显现象,随后需要进行的操作是_______;待烧瓶中出现明显实验现象后打开弹簧夹b,可观察到的实验现象为________;
(4)ZX3与ZM在催化剂作用下可生成两种对环境无污染的物质,反应的化学方程式为_______________________________________________________________________。
(5)某芳香化合物由X、Y两种元素组成,分子中Y原子数小于10,完全燃烧时生成YM2与X2M的物质的量之比为2:1。该化合物可使酸性高锰酸钾溶液褪色。写出该化合物的结构简式:____________________________。
25.(15分)有机物A能使石蕊试液变红,在浓硫酸作用下可发生如下转化:

甲、乙分子式均为C4H6O2且都能使溴的四氯化碳溶液褪色。
(1)甲分子所含官能团的名称是______________________________。A溶液与碳酸氢钠反应的化学方程式为____________________________________________________。
乙能发生的化学反应有(填序号)__________________。
a.酯化反应 b.氧化反应 c.水解反应
(2)B是A的同系物,相对分子质量小于A。B与浓硫酸作用得到的产物在一定条件下可发生加聚反应,该加聚反应的化学方程式为_______________________________。
(3)A的一种同分异构体D(结构中无甲基)是化学法生产氨酪酸的原料。氨酪酸属于氨基酸,有降低人体血氨和促进脑代谢的作用。D、E及氨酪酸之间有如图所示的
转化关系。(提示:ROH RCl)
RCl)

氨酪酸的结构简式为________________________________。
(4)A的另一种同分异构体简称EMC,用于制造可充电电池。EMC在氢氧化钠溶液中水解可得到三种含碳化合物。EMC的结构简式为________________________。
12.下列各组试剂用括号内药品加以鉴别,其中合理的是 ( )
A.氯化铵、硫酸钠、碘化钾、溴化钠(硝酸银溶液)
B.二氧化锰、氧化铜、四氧化三铁、活性炭(稀盐酸)
C.硫酸、硝酸镁、氯化铝、硫酸氢钾(碳酸钠溶液)
D.植物油、苯酚、甲苯、酒精(浓溴水)
第Ⅱ卷(非选择题 共11题 共180分)
11.某温度下,在容积固定不变的密闭容器中发生下列可逆反应:X(g) + 2Y(g) 2Z(g)。平衡时,X、Y、Z的物质的量分别为1 mol、1 mol、2 mol,保持温度不变,再向容器中分别充入1 mol、1 mol、2 mol的X、Y、Z,则下列叙述中正确的是( )
2Z(g)。平衡时,X、Y、Z的物质的量分别为1 mol、1 mol、2 mol,保持温度不变,再向容器中分别充入1 mol、1 mol、2 mol的X、Y、Z,则下列叙述中正确的是( )
A.刚充入时,反应速率v (正)减小,v (逆)增大
B.达到新平衡时,容器内气体的平均相对分子质量增大
C.达到新平衡时,容器内气体的压强是原来的两倍
D.达到新平衡时,容器内气体的百分组成和原来相同
9.下列各组离子在指定条件下,-定能大量共存的是 ( )
A.使石蕊试液变红色的溶液中:K+、Na+、CO32-、NO3-
B.在酸性高锰酸钾溶液中:Na+、NH4+、I-、Br-
C. c(H+)=10-1mol/L的溶液中:Cu2+、Al3+、SO42-、NO3-
D.水电离出的c(H+)=10-12mol/L的溶液中:Na+、Mg2+、Cl-、SO42-
|
A.25℃时,1 L pH=1的稀硫酸中所含H+数大于2×6.02×1022
B.0.2 mol氯气与足量的氢氧化钠稀溶液反应转移的电子数为0.2×6.02×1023
C.新戊烷与异戊烷的混合物7.2 g中所含共价键数目为1.6×6.02×1023
D.常温常压下,46 g NO2和N2O4混合气体中含有原子数为3× 6.02×1023
8.氢镍电池是一种应用广泛的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应为,据此判断  下列叙述中正确的是( )
下列叙述中正确的是( )
A.电池放电时,H2是正极
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,电池负极周围溶液的pH不断增大
7.下列各图所示的实验原理、方法、装置或操作,其中正确的是 ( )

6.下列说法正确的是 ( )
A.金属阳离子被还原时不一定得到金属单质
B.非金属元素的最高价含氧酸都具有强氧化性
C.由共价键形成的分子一定是共价化合物
D.直径介于1 nm~100 nm之间的微粒称为胶体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com