
27.(15分)X、Y、Z为三个不同短周期的非金属元素单质,常温下均为气体,A、B、C、D、E是中学常见化合物,在一定条件下有如图所示反应关系,反应条件和H2O在图中已略去,已知A的相对分子质量大于B,且A和B化合生成固体C时有白烟产生。回答下列问题:
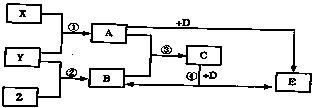
⑴X的化学式是 ;B的分子构型是 ,
C的水溶液显酸性的原因是(用离子方程式表示) ;
⑵反应④在实验室中用来制取B,写出该反应的化学方程式:
⑶若Y的燃烧热为MkJ·mol-1,写出Y在空气中燃烧的热化学反应方程式:
26.(15分)几种短周期元素的原子半径及某些化合价见下表:
|
元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
|
化合价 |
-1 |
-2 |
+4、-4 |
+4、-2 |
+5、-3 |
+3 |
+2 |
+1 |
|
原子半径/nm |
0.071 |
0.074 |
0.077 |
0.102 |
0.110 |
0.143 |
0.160 |
0.186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题。涉及上述元素的答案,请用元素代号表示。
⑴E元素在周期表中位于 周期, 族;
⑵A、H、J对应的离子半径由大到小的顺序是(填写离子符号) ;⑶A与J所形成化合物的晶体类型是 ,用电子式表示其形成过程
;
⑷B与H所形成的化合物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为 ;D与B形成的某种化合物Y不仅能与X反应,还能与I的单质反应,则Y与I的单质反应的化学方程式为 。
2.答卷前将答题纸密封线内的项目填写清楚。
13.用惰性电极电解下列电解质溶液,有关叙述正确的是 ( )
A.NaCl溶液完全电解后,要恢复到电解前状态,应加入适量的盐酸
B.Na2SO4溶液在电解过程中,阴极区pH值升高
C.电解CuSO4溶液,阳极反应式:2H2O+O2+4e-=4OH-
D.电解足量CuCl2溶液时,当阳极上生产2.24L气体时(标准状况)阴极增重12.8g
|
注意:1.用钢笔或圆珠笔直接答在试题卷中。
12.在标准状况下,将2.24LH2S气体通入到100mL1.4mol NaOH溶液中,充分反应,下列关系式不正确的是 ( )
A.c(Na+)+c(H+)=2c(S2-)+c(OH-)+c(HS-)
B.c(Na+)>c(S2-)>c(HS-)>c(HS-)>c(OH-)>c(H+)
C.c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+)
D.c(S2-)+c(HS-)+c(H2S)=1.0mol·L-1
11.下列反应的离子方程式书写不正确的是 ( )
A.硫酸铜水解:Cu2+ +2H2O=Cu(OH)2+2H+
B.澄清石灰水与少量小苏达溶液混合:Ca2++2OH3- +2HCO-=CaCO3↓+CO32-+2H2O
 C.氯化铝溶液加入过量的氨水:Al3+ +3NH3 ·H2O =Al(OH)3↓+3NH4+
C.氯化铝溶液加入过量的氨水:Al3+ +3NH3 ·H2O =Al(OH)3↓+3NH4+
D.NaHSO4溶液中滴加NaHCO3溶液:H+ +HCO3- =H2O+CO2↑
9.某有机物的结构简式为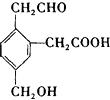 它在一定条件下能发生的反应有( )
它在一定条件下能发生的反应有( )
①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去
A.②③④ B.①③⑤⑥ C.①③④⑤ D.②③④⑤⑥
|
A.同时增大 B.同时减小
C.v1增大,减小v2 D.v1减小,增大v2
8.同周期的三种元素X、Y、Z,已知它们的最高价含氧酸的酸性由强到弱的顺序是: HXCO4>H2YO4>H3ZO4。则下列叙述不正确的是 ( )
A.非金属性X>Y>Z
B.X、Y、Z形成的阴离子的还原性逐渐增强
C.原子半径X<Y<Z
D.X、Y、Z的气态氢化物的稳定性逐渐增强
7.用表示阿伏加德罗常数,下列说法正确的是 ( )
A.0.2molH2O2完全分解转移的电子数目为0.4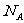
B.300mL2mol/L蔗糖溶液中所含分子数为0.6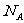
C.在常温常压下,17g硫化氢所含质子数目为8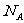
D.在标准状况下,2.24L二氧化硫与氧气混合气体中所含氧原子数为0.2 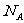
6.下列物质属于大气主要污染之一的是 ( )
A.可吸入颗粒物 B.白色污染物 C.黄曲霉素 D.亚硝胺
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com