
12.往200 mL 1.5 mol/L FeCl2溶液中缓慢通入2.24 L标准状况下的Cl2,充分反应后,所得溶液中Fe2+和Cl―的物质的量浓度之比为 ( )
A.1∶1 B.1∶2 C.1∶4 D.1∶8
11.在容积不变的密闭容器中进行如下反应:
H2O(g)+C(s) H2(g)+CO(g);△H>0
H2(g)+CO(g);△H>0
达到平衡后,改变下列反应条件,相关叙述正确的是 ( )
A.加入H2,平衡向逆反应方向移动,体系压强减小
B.加入少量C,正反应速率增大
C.降低温度,平衡向正反应方向移动
D.加入CO,混合气体的密度增大
9.常温时,以下4种溶液pH最大的是 ( )
A.0.01mol/L的醋酸溶液
B.pH=2的盐酸与pH=12的氨水等体积的混合液
C.0.03mol/L醋酸与0.01mol/L NaOH溶液等体积的混合液
D.0.02mol/L醋酸与0.02mol/LNaOH溶液等体积的混合液
|
A.蔗糖水解(H2SO4作催化剂)后,在水解液中加新制的Cu(OH)2悬浊液加热煮沸检验水解产物
B.用氨水清洗做过银镜反应的试管
C.除去苯中的苯酚,加饱和NaHCO3溶液再分液
D.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
8.下列各选项中,各类物质依次表示为X、Y、Z,其中与右下图三个圆所示的从属关系不相符的是 ( )
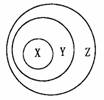
A.苯的同系物、芳香烃、烃
B.胶体、分散系、混合物
C.电解质、离子化合物、无机化合物
D.碱性氧化物、金属氧化物、氧化物
7.NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.2L 1mol·L-1 (NH4)2SO4溶液中含有4NA个铵根离子
B.100℃时,1L pH =6的纯水中,含1.0×10-6NA个H+
C.电解CuCl2溶液,阴极析出6.4gCu时,转移的电子数为0.1NA
D.一定条件下用含1mol FeCl3的溶液制备Fe(OH)3胶体,产生NA个Fe(OH)3胶粒
6.下列关于生活中化学叙述不正确的是 ( )
A.废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源
B.用灼烧并闻气味的方法可以区分纯棉织物和纯毛织物
C.SO2、NO2或CO2都会导致酸雨的形成
D.食用植物油的主要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质
29.(16分)已知两个羟基同时连在同一碳原子上的结构是不稳定的,它将自动发生脱水:
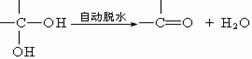
现有分子式为C9H8O2X2(X为未知元素)的物质M,可在一定条件下发生下述一系列反应 :
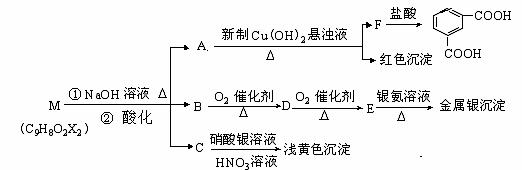
试回答下列问题:
(1)X为 (填元素符号);
(2)有机物A中所含的官能团为 (填名称),上述转化中其中属于氧化反应的共有_________步(填数字);M与NaOH溶液共热时的反应类型是 反应。
(3)M的结构简式为 。
(4)写出下列反应的化学方程:①B→D ;
②E与B在一定条件下发生反应的化学方程式: 。
28.(14分)用下图装置(酒精灯、铁架台未画出)制取三氯化磷,在短颈烧瓶d中放入足量白磷,将Cl2迅速而又不间断地通入d中,使氯气与白磷反应。水槽g中加入了冰水混合物。
已知:
(1)该实验条件下氯气与白磷的反应可能生成三氯化磷和五氯化磷两种产物。
(2)三氯化磷遇到水蒸气强烈反应,甚至发生爆炸。
(3)三氯化磷和五氯化磷的一些物理常数如下:
|
|
熔点 |
沸点 |
|
三氯化磷 |
-112℃ |
76℃ |
|
五氯化磷 |
148℃ |
200℃分解 |








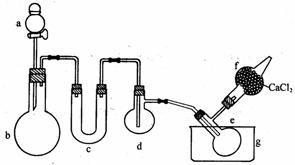
回答下列问题:
(1)实验前如何检验气体发生装置(图中虚线框部分)的气密性?
答: ___________________________________________________。
(2)图中a、b应该装入的试剂或药品分别是______________、_________________。
(3)装置c中应装入的药品是 。作用是____________________。
(4)实验中在_______(填图中仪器编号)中收集生成的三氯化磷,干燥管f中加入无水CaCl2的作用是 ,原因是____ 。
(5)上图装置缺少了一处装置,你认为缺少的是:_________________________。
27.(16分)下图中A-J分别代表相关反应中的一种物质,已知A分解得到相等物质的量的B、C、D,图中有部分生成物未写出,B为极性键构成的非极性气态分子,C、D具有相同的核外电子总数,D的水溶液呈碱性。
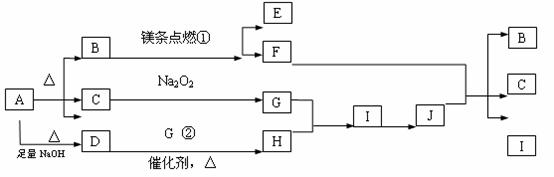
请填写以下空白:
(1)A的化学式为________ _____,B的结构式为 ,D分子的空间构型为 。
(2)写出反应②的化学方程式:
(3)写出反应③的离子方程式:
(4)完成C G的反应方程式,并标出电子转移方向和数目。
G的反应方程式,并标出电子转移方向和数目。
26.(本题包括2小题,共14分)
I(6分)、已知X、Y、Z、W四种短周期元素的原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。元素X与Y形成的1个分子中有3个极性共价键。
试推断:
(1)元素符号分别是:X:_________,Y:_________,Z:________,W:________。
(2)由X、Y、Z所形成的离子化合物与W的最高氧化物的水化物的浓溶液反应时的离子方程式是 。
II(8分)、长期以来一直认为氟的含氧酸不存在,但1971年一位美国化学家将F2通入细冰未中获得了HFO(次氟酸)。
(1)HFO的电子式为 ,其中氧元素的化合价为 。
(2)HFO与温水缓慢反应能得到某物质A和HF;物质A在化学上被认为是绿色氧化剂,分子A为 (选填“极性”或“非极性”)分子。请写出HFO与水反应的化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com