
10.将同浓度、等体积的AgNO3、NaCl、K2SO4三种溶液,同时倒入使用惰性电极的电解槽中,充分混合后,通电片刻,则氧化产物与还原产物的质量比为 ( )
A.35.5∶108 B.16∶137 C.8∶1 D.108∶35.5
9.下列实验设计,操作或分析合理的是 ( )
①完成中和热测定的实验时,如果没有环形玻璃棒,可用环形铜质搅拌棒代替;
②实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到含高级脂肪酸钠的混合物
③在测定硫酸铜晶体的结晶水含量时,加热过程中不慎有晶体飞溅出来,将会造成测定结果偏高;
④用食醋和澄清石灰水验证蛋壳中含有碳酸盐;
⑤用硝酸钡溶液鉴别硫酸根离子与亚硫酸根离子。
A.②③④ B.①③⑤ C.①②④ D.②③⑤
8.将甲、乙两种金属的性质相比较,已知①甲跟H2O反应比乙与H2O反应剧烈;②甲单质能从乙的盐溶液中置换出单质乙;③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲单质的熔、沸点比乙的低。能说明甲的金属性比乙强的是 ( )
A.①④ B.③⑤ C.①②③ D.①②③④⑤
7.NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.0.1mol·L-1的醋酸钠溶液中含CH3COOH、CH3COO-粒子总数为0.1NA
B.标准状况下,2.24L NH3和CH4的混合气体,所含电子总数为NA
C.含1mol硅原子的SiO2晶体中Si-O键的个数为2NA
D.分解H2O2制O2,每生成1mol O2转移4NA个电子
6.下列各组热化学方程式(同温、同压下)中Q1大于Q2(Q1、Q2为正值)的有( )
①S(g)+O2(g)=SO2(g);△H=-Q1kJ/mol
S(s)+O2(g)=SO2(g);△H=-Q2kJ/mol
②C(s)+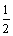 O2(g)=CO(g);△H=-Q1kJ/mol
O2(g)=CO(g);△H=-Q1kJ/mol
C(s)+ O2(g)=CO2(g);△H=-Q2kJ/mol
③4Al(s)+3O2(g)=2Al2O3(s);△H=-Q1kJ/mol
4Fe(s)+3O2(g)=2Fe2O3(s);△H=-Q2kJ/mol
④2H2(g)+O2(g)=2H2O(g);△H=-Q1kJ/mol
2H2(g)+O2(g)=2H2O(l);△H=-Q2kJ/mol
A.①② B.③④ C.②④ D.①③
29.(20分)甲同学想通过下图所示装置(夹持装置已略去)进行实验,研究推断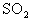 与
与 反应的产物。
反应的产物。
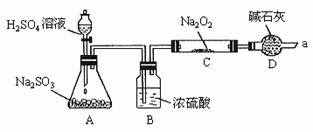
回答下列问题:
(1)装置B的作用____________________________________________________。
装置D的作用____________________________________________________。
(2)如何检验反应中是否有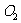 生成
生成
_____________________________________________________________。
(3)假如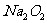 已反应完全,为确定C中固体产物的成分,甲设计如下实验:
已反应完全,为确定C中固体产物的成分,甲设计如下实验:

得出结论:产物是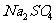 。该方案是否合理___________(填是或否),理由是__
。该方案是否合理___________(填是或否),理由是__
_________________________________。
(4)若上述方案不合理,请设计一个能确定产物成分的实验方案,填写下表(可不填满)。

28.(15分)某有机物A的分子式为C6H8O7,对其进行如下实验。
①将 1.92 g A与100 mL 0.3 mol/L碳酸氢钠溶液混合,恰好反应。
②在一定条件下,能与乙酸发生酯化反应。
请根据题目要求回答问题。
(1)推测A的分子结构中具有的官能团 (写名称)。
(2)若经测定A的结构中无甲基,则A可能的结构简式有 种。其中一种结构为柠檬酸,已知柠檬酸结构中相同的官能团不是连接在同一个碳原子上,且柠檬酸在铜催化条件下不会被氧化,则柠檬酸的结构简式为 。
(3)写出柠檬酸与足量碳酸氢钠溶液反应的化学方程式 。
(4)在一定条件下柠檬酸可以发生化学反应的类型有 (填序号)。
A.取代反应 B.加成反应 C.消去反应 D.中和反应 E.加聚反应
(5)柠檬酸和部分有机物的熔沸点见下表
|
|
乙酸 |
乙醇 |
乙酸乙酯 |
柠檬酸晶体 |
柠檬酸乙酯(液体) |
|
沸点(℃) |
118 |
78.5 |
77.1 |
|
294 |
|
熔点(℃) |
|
|
|
153 |
-55 |
由数据分析柠檬酸与乙醇发生酯化反应,用如下图的装置,在试管②中,能否收集到柠檬酸乙酯(填“能”或“不能”),原因是 。
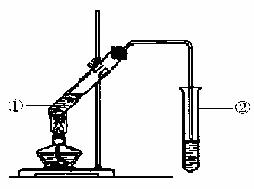
(6)写出柠檬酸与足量乙醇完全酯化反应的化学方程式 。
27.(14分)A-J为中学化学中常见的几种物质。它们有如图转化关系:
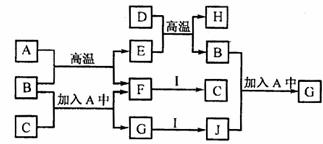
常温下,A为生活中常见的无色无味液体,F、I为气体单质,B、D为常见金属,I分子中电子总数为34。H既能与酸反应,又能与碱反应。回答下列问题:
(1)写出下列物质的化学式:A ,C
(2)写出工业上冶炼D的化学方程式: :
(3)写出E与氢碘酸发生氧化还原反应的离子方程式: ;
(4)证明G中含有B元素的方法是(写出操作、现象及结论)
(5)从J的水溶液中获取工的晶体,应首先向J的水溶液中通入C的原因是
,然后的实验操作是 、过滤、洗涤、干燥。
26.(12分)短周期元素A、B、C、D、E的原子序数依次增大,A与C、B与D分别同主族,A与E能形成化学式为AE型的共价化合物,C与D能形成化学式为C2D型的离子化合物。
(1)AE的电子式为 。
(2)C的单质在B的单质中燃烧,生成物中含有的化学键为 。
(3)用惰性电极电解C2DB4的水溶液时,阳极反应式为 。
(4)与C同周期的某金属元素单质,溶于由A、B、C三种元素组成的化合物的水溶液时,反应的离子方程式为 。
(5)由B、C、D三种元素组成的某化合物,与稀硫酸反应并生成沉淀的化学方程式为
。
13.拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊醋的结构简式如下图:下列对该化合物叙述正确的是 ( )
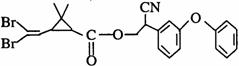
A.属于芳香烃
B.该有机物的化学式为C22H21NBrO3
C.在酸性条件下不水解
D.在一定条件下可以发生加成反应
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com