
12.关于下列装置的叙述,不正确的是 ( )

A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、Cl2、CO2、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢气体,并可防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
11.以下说法正确的是 ( )
A.原子是化学变化中的最小微粒,所以化学反应中不可能产生新的元素
B.1H2、2H2、3H2都是氢元素的核素
C.某阴离子的结构示意图为
D.非金属元素原子间只能形成共价键,金属元素原子与非金属元素原子间只能形成离子链
9.下列说法不正确的是 ( )
A.在有机物中碳原子与其它原子最多形成4个共价键
B.用溴水既可以鉴别甲烷和乙烯,也可以除去甲烷中的乙烯
C.煤中含有大量的苯、甲苯、二甲苯等有机物,因此可以通过干馏的方法将其提纯出来
D.油脂、淀粉、蛋白质都是人体必需的营养物质,它们都可以在一定条件下发生水解
|
A.2L 0.5mol·L-1的NH4Cl溶液中含有NA个NH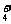
B.18g D2O中含有10NA个电子
C.Na2O2与水反应生成1mol O2转移NA个电子
D.46gNO2和N2O4的混合物中含有的原子总数一定是3NA个
29.(19分)某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式为
 (其中Ⅰ、Ⅱ为未知部分的结构)。
(其中Ⅰ、Ⅱ为未知部分的结构)。
为推测X的分子结构,进行如下图的转化:

已知向E的水溶液中滴入FeCl3溶液发生显色反应;M(C2H2O4)能使蓝墨水褪色;G、M都能与NaHCO3溶液反应。
请回答:
(1)M的结构简式为_____________;G分子所含官能团的名称是______________;
(2)E可以发生的反应有(选填序号)___________;
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(3)由B转化成D的化学方程式是_____________________________________;
(4)G在一定条件下发生反应生成分子组成为C4H4O4的有机物(该有机物可使溴的四氯化碳溶液褪色),写出G发生此反应的化学方程式。
_____________________________________________________________;
(5)已知在X分子结构中,I里含有能与FeCl3溶液发生显色反应的官能团,且E分子中苯环上的一氯代物只有一种,则X的结构简式是:_____________________;
(6)F与G互为同分异构体,F的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基。则F的分子结构有________种。
28.(12分)下图中A、B均为固体,其中B为单质。下图可用于工业生产F。回答下列问题:

(1)A的化学式为______________。
(2)反应①是一个氧化还原反应,该反应发生时,每生成4mol气体C,转移电子_____mol。
(3)反应②是可逆反应,在2L的密闭容器中投入4mol C和3molX,10分钟后反应达到平衡,平衡时混合气体共6mol,则下列说法正确的是_______(填写序号字母)。
A.工业制取F时,C和X生成E的反应是在吸收塔进行
B.这10分钟内,X的平均反应速率是0.1mol/ (L·min)
C.当C和X的消耗速率比为2∶1时,标志着反应达到平衡
D.平衡时C的转化率是50%
E.在工业生产中可以通过增加X浓度来提高C的转化率
(4)将50mL 0.02mol/L的F溶液与50mL 0.02mol/L NaOH溶液充分混合,若混合后溶液的体积为100mL,则混合液的pH是______________。
27.(16分)下表由元素周期表的前三周期去掉副族上方空区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处。请回答下列问题:
|
a |
 |
 |
|
|
|
|
|
|
|
|
|
b |
c |
d |
e |
|
|
f |
|
g |
|
|
|
|
|

(1)g的最高价氧化物对应的水化物与f的最高价氧化物对应的水化物的溶液反应,请 写出该反应的离子方程式______________________________________________。
(2)第三周期8种元素按单质熔点(℃)大小顺序的柱形图(上左图,已知柱形“1”代表Ar),则其中序列“2”代表_________,“8”代表__________。(均填化学式)
(3)b、c、d、e、f的氢化物的沸点直角坐标图(上右图),分别写出序列“1、2、5”氢化物的化学式为_____________、______________、____________。
(4)单质a和单质d可以设计为新型燃料电池,电解质为KOH溶液,则单质d在该燃料电池的______极发生电极反应,电极反应式为__________________________。
26.(13分)已知稀溴水和氯化铁溶液都呈黄色,现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色。
(1)甲同学认为这不是发生化学反应所致,则使溶液呈黄色的物质是:_________(填粒子的化学式,下同);
乙同学认为这是发生化学反应所致,则使溶液呈黄色的物质是_____________。
(2)你认为哪位同学的观点是正确的?_________(填“甲”或“乙”),为了验证你的判断的正确性,请根据下面所提供的可用试剂,用两种方法加以验证,请将选用的试剂代号及实验中观察到的现象填入下表。
实验可供选用试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液
C.四氯化碳 D.硫氰化钾溶液
E.硝酸银溶液 F.碘化钾淀粉溶液
|
实验方案 |
所选用试剂(填代号) |
实验现象 |
|
方案一 |
|
|
|
方案二 |
|
|
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,则首先被氧化的离子是___;若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为是否可行?____;理由是:_____________________________________________________。
(4)若向100.0mL溴化亚铁溶液中通入标准状况下的Cl2 3.36L,充分反应后测得溶液中Cl-与Br-的物质的量浓度相等,则原溴化亚铁溶液的物质的量浓度为_______
mol/L。所发生反应的总离子方程式为:__________________________。
13.常温下,向0.1 mol/L的H2SO4溶液中逐滴加入0.1 mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是 ( )
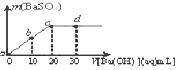
A.a~d溶液的pH:a<b<c<d
B.a~d溶液的导电能力:a<b<c<d
C.b处溶液的c(H+)与d处溶液的c(OH-)相等
D.c处溶液和d处溶液均呈碱性
|
12.将a mol纯铁粉投入含HNO3 b mol的稀溶液里,恰好完全反应并放出NO气体,则a和b的关系是 ( )
A.a/b=1/4 B.a/b=3/8 C.1/4≤a/b≤3/8 D.a/b的值无法确定
11.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
|
A.放电时负极反应为:Zn-2e-+2OH -=Zn(OH)2
B.放电时每转移3mol电子,有3mol K2FeO4被氧化
C.放电时正极附近溶液的碱性增强
D.充电时阳极反应为:Fe(OH)3-3e-+5OH -=FeO42-+4H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com