
33.(8分)[化学--有机化学基础]
2005年诺贝尔化学奖授予法国化学家伊夫·肖万和两位美国化学家罗伯特·桥梁拉布和理查德·施罗克,以表彰他们在烯烃复分解反应研究和应用方面做出的卓越贡献。烯烃复分解反应实际上是在金属烯烃络合物的催化下实现碳碳双键两边基团换位的反应,如下反应表示两个丙烯分子通过复分解反应生成新的烯烃乙烯和丁烯。

现以石油裂解得到的丙烯为原料,经过下列反应可以分别合成重要的化工原料I和G。I 和G在不同条件下反应可生成多种化工产品,如环酯J。
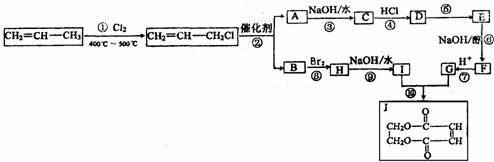
请按要求填空:
(1)写出反应类型① ⑥ 。
(2)写出E的结构简式 。
(3)写出下列化学方程式
反应② 。
反应⑩ 。
32.(8分)[化学--物质结构与性质]
下图是Na、Cu、Si、H、C、N等元素单制裁的熔点高低顺序,其中c、d均是热和电的良导体。

(1)请写出上图中d单质对应元素原子的电子排布式 。
(2)单质a、f对应的元素以原子个数比2:1形成的分子(相同条件下对氢气的相对密度为14)中含 个δ键和 个π键。
(3)a与b的组成元素形成的10电子中性分子的空间构型是 ;由该分子构成的物质易液化的原因是 。
(4)e对应的元素形成的氧化物的晶体类型为 晶体。
31.(8分)[化学--化学与技术]
工业炼铝是用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的主要原料氧化铝,然后进行电解。工艺流程如下图:

(1)滤液1中要加入稍过量的原料B,原料B的化学式是 。
(2)如果省去步骤①,即溶解铝土矿从直接加入原料B开始,则最终会对氧化铝的生成有什么影响? 。
(3)步骤⑤是在铝电解槽中进行,电解槽的两极材料均用石墨,其中 极的材料随反应的进行需要不断补充,为什么? 。
(4)铝粉与三氧化二铁粉末在引燃剂作用下常用来焊接钢轨,主要是利用了该反应
,而且该反应焊接速度快、设备简易,适于野外作业。
30.(15分)下面是某学习小组进行研究性学习的过程:
[研究课题]探讨溶液中Fe3+和SO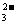 之间发生的反应类型
之间发生的反应类型
[提出猜想]同学们对溶液中Fe3+和SO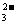 之间的反应进行了猜想,提出了如下观点:
之间的反应进行了猜想,提出了如下观点:
I、认为发生相互促进的水解反应,其离子反应方程式为:
2Fe3++3SO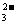 +6H2O=2Fe(OH)3(胶体)+3H2SO4
+6H2O=2Fe(OH)3(胶体)+3H2SO4
II、认为发生氧化还原反应,其离子反应方程式为:
2Fe3++SO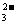 +H2O=2Fe2++2H++SO
+H2O=2Fe2++2H++SO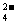
[实验验证]为验证“猜想”,同学们实验如下:
(1)取一定量的Na2SO3固体配成Na2SO3浓溶液。
(2)取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,溶液颜色先由黄色变为红棕色,但无气泡产生,无沉淀生成;继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色溶液。
(3)换用稀释的FeCl3和Na2SO3溶液重复上述实验,产生的现象完全相同。
(4)为判断红褐色溶液中含有Fe(OH)3从而证明猜想I正确。
①部分同学认为只要证明该体系为胶体即可,因此通过 现象设计实验方案,证明了其为Fe(OH)3胶体。
②部分同学从反证法的角度考虑,认为只要证明红褐色溶液中仍然有+3价的铁,可说明Fe3+没有被还原为Fe2+则猜想II不正确,设计方案为 ,观察到 ,从而说明红褐色溶液中含有+3价的铁。
(5)另有部分同学认为只要证明红褐色溶液中含有SO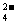 可判断猜想II正确,因此设计方案为
,观察到有白色沉淀生成。
可判断猜想II正确,因此设计方案为
,观察到有白色沉淀生成。
[解释结论]综合(4)(5)考虑,Fe3+与SO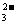 的反应类型为
。
的反应类型为
。
[实验反思]某同学认为(5)中SO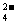 来源不一定是被Fe3+氧化得到的,因此不能推断猜想II正确。你是否赞成该同学的观点
(填“是”或“否”)。如果赞成,你对实验改进的建议
(如果不赞成,该问不必作答)。
来源不一定是被Fe3+氧化得到的,因此不能推断猜想II正确。你是否赞成该同学的观点
(填“是”或“否”)。如果赞成,你对实验改进的建议
(如果不赞成,该问不必作答)。
[拓展探究]鉴于Na2SO3在组成上与Na2SO3相似,某同学在FeCl3溶液中加入Na2SO3溶液,马上观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是
;同学们交流后认为二者水溶液与氯化铁溶液反应的现象差别很大,除SO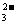 有较强的还原性而CO
有较强的还原性而CO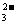 没有的原因外,还可能有的原因是
。
没有的原因外,还可能有的原因是
。
|
29.(15分)A~L的转化关系如下图所示(部分反应条件和产物未标出),其中C、F为气体单质,且C呈黄绿色,F呈无色,A、J、L为常见氧化物。
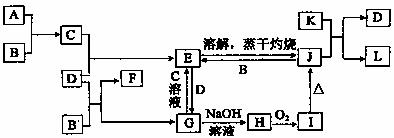
试根据推断回答下列问题:
(1)写出A、B反应生成C的离子方程式: 。
(2)写出由H生成I的化学方程式: 。
(3)A、C、E、G氧化性由强到弱的顺序为 (用相应物质的化学式表示)
(4)E的溶液可以做净水剂,用离子方程式和必要的文字解释其净水原理:
。
(5)K物质可能为(至少写两种) 。
(6)某同学设计了一种电解法制取H的实验装置(如下图所示)。通电后,溶液中产生大量的H,且较长时间不被氧化。
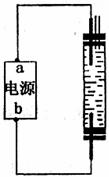
下列说法中正确的是 。
A.阴、阳两极的材料必须相同
B.可以用NaOH溶液作为电解液
C.可以用NaCl溶液作为电解液
D.a一定为正极,b一定为负极
E.阴极发生的反应是:2H++2e-=H2↑
28.(12分)(1)下图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。

(2)已知25℃时,0.1mol·L-1的HF溶液中的c(H+)=1.8×10-5mol·L-1,Ksp(CaF2)=1.46×10-10mol3·L-3。现向1L 0.2mol·L-1HF溶液中加入1L 0.2mol·L-1CaCl2溶液,下列说法正确的是 。
A.0.1mol·L-1的HF溶液pH=1
B.Ksp(CaF2)随钙离子和氟离子浓度的增大而增大
C.该体系最终没有沉淀生成
D.该体系最终有沉淀生成
(3)常温下在20m L 0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液40mL,溶液中含碳元素的各种微粒(除CO2因逸出而未画)物质的量分数(纵轴)随溶液pH(横轴)变化的情况如下图。
请根据下图所示回答下列问题:
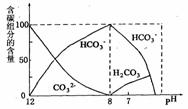
①在同一溶液中,H2CO3、HCO 、CO
、CO (填“能”或“不能”) 大量共存。
(填“能”或“不能”) 大量共存。
②当pH=7时,用一个数学表达式表示溶液中各种离子的物质的量浓度之间的等量关系: 。
③已知在25℃时,CO (aq)水解反应的平衡常数:
(aq)水解反应的平衡常数:
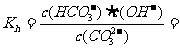 2×10-4mol·L-1
2×10-4mol·L-1
当溶液中c(HCO ):c(CO
):c(CO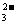 )=2:1时,溶液的pH=
。
)=2:1时,溶液的pH=
。
0.4 mol·L-1C反应,达平衡后,C的浓度仍为0.4 mol·L-1
D.其它条件不变,升高温度,正、逆反应速率增大,且A的转化率增大
15.在温度为T时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(I)所示。若保持其他条件不变,温度分别为T1、T2时,B物质的体积分数与时间关系如图(II)所示。则下列结论不正确的是 ( )
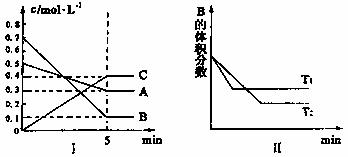
A.在温度为T时的平衡常数是533.3L2·mol-2
B.在温度为T达平衡时用B物质表示平均速率为v(B)=0.12mol·L-1·min-1
C.在温度为T时在相同的容器中,若加入0.3mol·L-1A、0.1 mol·L-1B、
14.2007年10月24日18时05分,我国自行研制的“嫦娥一号”月球探测卫星在西昌卫星发射中心由“长征三号甲”运载火箭顺利发射成功。“长征三号甲”运载火箭的第一、第二级发动机燃料为偏二甲肼(C2N2H8)和四氧化二氮,发生的反应为:
C2N2H8+2N2O4=2CO2+4H2O+3N2,第三级发动机燃料为H2和O2。下列说法不正确的是( )
A.推动火箭飞行的强大动力源于各级反应产生的大量气体
B.偏二甲肼(C2N2H8)和液氧分别作为各级发动机反应中的氧化剂
C.硅是制作“嫦娥一号”等航天器太阳能帆板的基础材料
D.“嫦娥一号”探测器外壳可采用耐高温的纤维、金属、陶瓷等复合材料
13.一定温度下,用水稀释0.1mol·L-1的稀氨水,若用Kw表示水的离子积,Kb表示氨水的电离常数,α表示氨水的电离程度,则下列数值随稀释而增大的是 ( )
A.c(OH-) B. C.
C.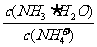 D.
D.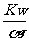
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com