
21.(8分)某化学兴趣小组为探究铜跟浓硫酸的反应,用下图装置进行有关实验。请回答下列问题:
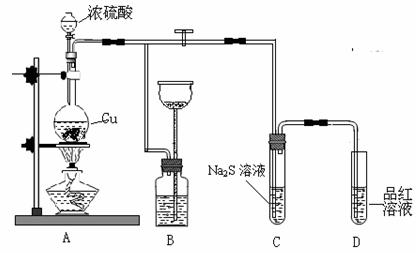
(1)装置A中发生的化学反应的化学方程式为____________.
(2)装置B可作储气之用,称之为储气瓶,B中广口瓶内应盛放的液体是__(填序号)
①水 ②酸性KMnO4 ③NaHCO3溶液 ④NaOH溶液
(3)装置C中观察到的现象______________,装置D中观察到的现象_______________。
20.(9分)下图是中学化学中常见物质间的反应转化关系图,其中部分产物已略去。常温下,G为固体单质,B、I为液体,其余都为气体。A为化合物,I的浓溶液与G在加热条件下生成F、B和C。H可用作工业冶炼金属的还原剂。请按要求填空:
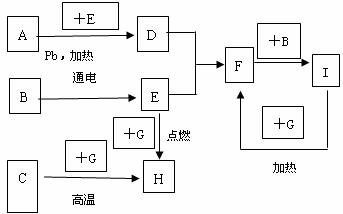
(1)写出下列物质的化学式:
A.____________,B.____________,C.____________。
(2)写出A →D的化学方程式:________________________________________。 (3)写出G和I的浓溶液反应的化学方程式:_______________________________。
(4)工业上制I的尾气中通常混有D和F, D和F都是大气污染物,工业上通常用苛性钠溶液来吸收尾气中的D和F,请写出相关的化学方程式: __________________________、
___________________________________________;要使D和F被完全吸收,其物质的量关系必须满足:______________________,为达到这个要求,可以向尾气中通入一定量的________来调节D和F的物质的量关系。
19.(4分)晶体硅是一种重要非金属材料。制备纯硅的主要步骤如下:
①在高温下,用碳还原SiO2制得含碳、脉石(主要成份为SiO2)等杂质的粗硅
②将粗硅在高温下与Cl2反应生成SiCl4
③将分馏提纯后的SiCl4用H2还原以得到高纯硅
用化学方程式表示上述制备过程
①_______________________________________________________________________。
②_______________________________________________________________________。
③_______________________________________________________________________。
步骤③过程中所用H2,工业上可用粗硅与NaOH溶液反应制备,反应化学方程式为
_________________________________________________________________________。
18.(6分)在一定条件下,某短周期元素的氢化物X可完全分解为两种单质:Y和Z。若已知:
①反应前X与反应后生成的Z物质的量之比n(X):n(Z)=2:3
②单质Y的分子为正四面体构型
请填写下列空白
(1)单质Y是______ , 单质Z是______(填写名称或分子式)
(2)1 mol Y 分子中含______mol 共价键
(3)X分解为Y和Z的化学方程式:______________________________________。
17.(5分)将NaNO3晶体与浓H2SO4、铜屑混合共热,观察到的现象是________________,
反应方程式为_________________________、____________________________________。
若要鉴定KNO3稀溶液中含NO3-,应采用的操作方法是:__________________________________________________________________________。
16.将8.4 g Fe溶于一定量稀HNO3中完全反应后,测得溶液中(Fe2+)= (Fe3+), 则稀HNO3中含稀HNO3的物质的量为
A.0.4 mol B.0.8 mol C.0.5 mol D.0.2 mol
第Ⅱ卷(非选择题,共56分)
15.在常温常压下,将a L SO2和b L H2S混合,当反应后气体体积是反应前气体体积的四分之一时,则a与b之比为
A.1:1 B.1:2 C.1:3 D.1:4
14.同温同压下,将充有NO2、NO和O2的大试管倒置于水中,片刻之后水溶液充满整个大试管,则反应前NO2、NO和O2的体积比可能是
A.1:1:1 B.4:24:5 C.4:24:7 D.4:24:19
13.下列物质与HNO3反应时,HNO3既表现强氧化性又表现酸性的是
A.Fe(OH)2 B.CuO C.C D.Cu
12.一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000
mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
提示:①H2C2O4是二元弱酸
②10[KHC2O4·H2C2O4·2H2O]+8 KMnO4+17H2SO4===8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.008889 B.0.08000 C.0.1200 D.0.2400
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com