
9.下图是一燃料电池化学原理示意图,该燃料电池总反应化学方程式为:
2CH3OH+3O2+4KOH 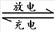 2K2CO3+6H2O以下判断不合理的是 ( )
2K2CO3+6H2O以下判断不合理的是 ( )
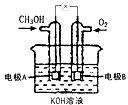
A.电极A为电池负极 B.电极B表面上发生还原反应
C.溶液pH保持不变 D.燃料电池工作时不会出现火焰
8.下列化学用语的表述正确的是 ( )
A.NaHCO3溶于水时电离NaHCO3  Na+ + HCO3-
Na+ + HCO3-
B.金属铝溶于稀硫酸中Al+2H+=Al3++H2↑
C.S2-的结构示意图为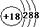
D.钢铁发生吸氧腐蚀的正极反应:O2 + 4e- + 2H2O = 4OH-
7.短周期元素A、B、C在元素周期表上的位置关系如下图所示,下列推断正确的是( )
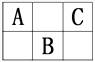
A.A、B、C可能都是金属元素
B.它们的单质在常温常压下可能都是气体
C.三原子的核外电子数之和不可能为偶数
D.原子半径B>C>A
6.排放到大气的物质往往对环境有利弊二重性。下列相关叙述与事实不符的是 ( )
A.植物光合作用需要CO2,但是大气中CO2过多其温室效应会导致气候恶化
B.汽车尾气中的NO会污染城市空气,雷电产生的NO会转化为NO3-并随雨水滋养地表植物
C.臭氧层中的O3可以吸收宇宙射线福佑生灵,地表上的O3却可能伤害人的呼吸道
D.少量Cl2可用于水体净化消毒,大量Cl2会导致水体富营养化
29.(13分)研究性学习小组的同学为了了解Cu及其化合物的性质,提出以下问题:
①Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②Fe的+2价化合物的稳定性比+3价化合物的稳定性小,Cu的+l价化合物的稳定性也比+2价化合物的稳定性小吗?
③CuO能被H2、CO等还原,也能被NH3还原吗?
(1)解决问题①需要用到的药品有CuSO4溶液、 、 (填字母)。
A.A1C13溶液 B.NaOH溶液 C稀H2SO4 D.H2O2溶液
假若Cu(OH)2具有两性,应该看到的实验现象是 。
(2)为了比较Cu的+1价化合物和+2价化合物的稳定性,他们取98gCu(OH)2;固体,加热至80℃一100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末X。冷却后称量,X的质量为72g。向X中加入过量稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在:据此可推得,X的化学式为 ,可以得出的结论是 。
(3)为解决问题③,设计了如下的实验装置(夹持及尾气处理装置未画出): ,
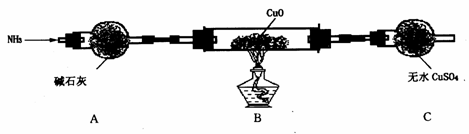
在实验中观察到CuO变成红色物质,无水CuSO4变成蓝色,生成物中还有一种无污染的单质气体。装置A的作用是_____________________________,B中发生反应的化学方程式为______________________________________。
28.(16分)苯的同系物与卤素单质混合,在光照条件下,侧链上的氢原子被取代;在催化剂存在的条件下,苯环上的氢原子被取代。
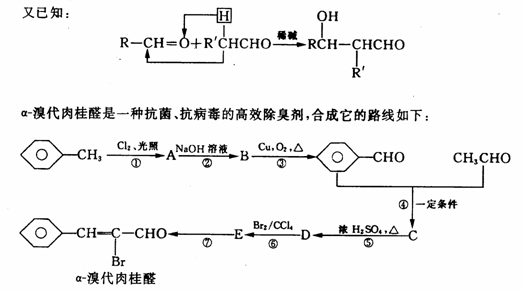
(1)写出反应类型:⑤ ,⑥ 。
(2)写出②的化学方程式: 。
(3)经反应⑦得到的有机物除α-溴代肉桂醛外,还有另外两种有机物,它们的结构简式分别为 、 。
(4)B经催化氧化还可得到另一种有机物F,F可与B反应生成具有果香味的G物质,写出生成G的化学方程式 。
27.(15分)在常温下,A、B是金属单质,C2是黄绿色气体,D2是最轻的气体,G为能溶于Y溶液的白色胶状沉淀,F的水溶液遇苯酚显紫色。这些物质相互转化的关系如下图所示,反应②是一种重要的化工生产反应。
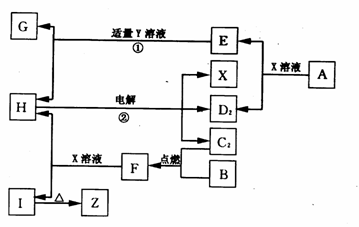
请回答下列问题:
(1)X的化学式为 ,Y的化学式为 。
(2)将F的水溶液加热蒸干并灼烧所得的固体物质是 (填化学式)。
(3)写出反应②的化学方程式:
(4)写出反应①的离子方程式:
(5)写出A和Z在一定条件下反应的化学方程式:
26.(16分)由第一周期元素和第二周期元素组成的几种分子如下:
①NH3 ②NH2OH(羟胺) ③NO ④N2H4(肼) ⑤H2O2
试回答下列问题
(1)H2O2是一种绿色氧化剂,写出用H2O2与铜在稀硫酸作用下制硫酸铜的离子方程式:
(2)NO可以结合血红蛋白生成一氧化氮血红蛋白引起中毒。若要使NO转化为无毒气体,可用NH3在催化剂存在的条件下加热与其反应,根据氧化还原反应的原理,写出该反应的化学方程式
(3)NH3的球棍模型为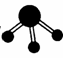 , 请画出NH2OH的球棍模型
, 请画出NH2OH的球棍模型
工业上可用电解硝酸的方法制得NH2OH,电解硝酸制NH2OH时阴极的离子方程式是:
(4)N2H4可以作为火箭推进剂,已知16克液态N2H4与液态H2O2反应生成两种气态物质,放出321.1kJ热量,写出该反应的热化学方程式 。
13.可逆反应mA(s)+nB(g) pC(g);△H<0。在一定温度下,平衡时B的体积分数(B%)与压强的关系如图所示,下列叙述中一定正确的是 ( )
pC(g);△H<0。在一定温度下,平衡时B的体积分数(B%)与压强的关系如图所示,下列叙述中一定正确的是 ( )
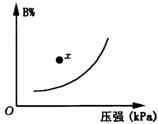
A.m + n > p
B.x点时正反应速率大于逆反应速率
C.升高温度平衡向正反应方向移动
D.升高温度,逆反应速率增大,正反应速率减小
12.一种锂电池用二氧化钴作正极、嵌有锂原子的石墨(以LiC6表示)作负极、LiCoO2作
电解质,其电池反应可表示为: LiC6+CoO2 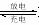 LiCoO2+ C6下列电极反应不正确的是 ( )
LiCoO2+ C6下列电极反应不正确的是 ( )
A.放电时,负极反应为:LiC6-e-==Li++ C6
B.放电时,正极反应为:Li++CoC2-+e-== LiCoO2
C.充电时,阴极反应为:Li++ C6+e-== LiC6
D.充电时,阳极反应为:CoO2-- e-=CoO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com