
1、下列物质能与溴水发生化学反应并使溴水褪色的是:
A、乙醇 B、乙烯 C、苯 D、甲烷
31.化学选考题
A.[化学---化学与技术]
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+
3H2(g) 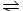 3NH3(g) △H=-92.2kJ·mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:
3NH3(g) △H=-92.2kJ·mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:
催化剂:铁触媒,温度400℃~500℃,压强:30MPa~50MPa。
回答下列问题:
(1)合成氨工业中原料气压缩到30MPa~50MPa的原因是
;从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400℃~500℃的高温,原因是
。
(2)500℃、50MPa时,在容积为1L的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K= 。
(3)甲烷在高温下与水蒸气反应的方程式为:CH4+H2O=CO+3H2。已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CH4和H2O在高温下反应的热化学方程式 。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃烧电池。请写出该电池的正极反应式
。
B.[化学---物质结构与性质]
aA、bB、cC、dD、eE、均为短周期元素,a<e<c<b<d,e+c+d=31,A和B同主族,C 和D也同主族,C、E相邻,A与其它元素均不同周期。
①A、E形成的四原子核化合物属 分子(极性、非极性),其中心原子的杂化类型
其分子易液化,原因是: 。
②A、C形成的四原子核分子甲(甲是一种常见的“绿色氧化剂”)的结构式为 ;
③从五种元素中任选三种元素,组成化合物x和y,在下列表格中按要求填写相应的化学式(每空只写一种即可)
|
x pH>7 |
y pH<7 |
|
抑制水的电离
|
抑制水的电离
|
|
促进水的电离
|
促进水的电离
|
C.[化学--有机化学]
有机玻璃是一种重要的塑料,有机玻璃的单体A(C5H8O2)不溶于水,并可以发生以下变化:
请回答:
(1)B分子中含有的官能团是____________________。(填名称)
(2)由B转化为C的反应属于(选填序号) ________。
①氧化反应 ②还原反应 ③加成反应 ④取代反应
(3)C的烃基一氯代物D有两种,C的结构简式是_____________。
(4)由A生成B的化学方程式是__________________________________________。
(5)有机玻璃的结构简式是___________________________________
2.已知2SO2(g)+O2(g) 2SO3 (g)
2SO3 (g)
(3)该反应的平衡常数表达式为K =_______________________;
(4)已知上述反应为放热反应,则其反应热DH________零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值________(填“增大”、“减小”或“不变”);
(5)若使SO3浓度增大,则上述平衡向_______反应方向移动(填“正”或“逆”);
(6)若已知在2L 的密闭容器中2min 内消耗O2为8moL,则SO3的生成速率为v (SO3) =__________mol/(L·min)。
1.(1) 配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应中氧化产物与还原产物的物质的量之比为
27.(14分)
二氧化硫、二氧化氮是大气的污染物。为消除NO2 对大气的污染可通过反应:
□NO2+□N H3 □N2+□H2O 消除
□N2+□H2O 消除
26.(15分)
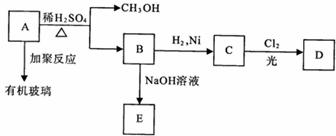
某兴趣小组设计出下图所示装置来改进教科书中“铜与硝酸反应”实验,以探究化学实验的“绿色化学”。
(1)实验前,关闭活塞b ,试管d 中加水至浸没长导管口,塞紧试管c和d 的胶塞,用热毛巾捂住C对其加热 ,其目的是______________________________________。
(2)在d 中加适量NaOH 溶液,c 中放足量铜片,由分液漏斗a 向c中加人2mL 浓硝酸,c 中反应的化学方程式是___________________________________________________;
再由a 向c 中加2 mL 蒸馏水,c 中的实验现象是___________________________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是______,理由是_______________________________。

(4)该小组还用上述装置进行实验证明氧化性KMnO4 > Cl2 > Br2。操作步骤为_________
_____,实验现象为________。但此实验的不足之处是________________。
25.(15分)
|
A.配制0.1mol/L的氯化钠溶液时, 将称量的氯化钠固体直接加入容量瓶,再加水至刻度线
B.用洁净且干燥的玻璃棒蘸取待测液滴到放在表面皿上的pH试纸上,与标准比色卡对照,测溶液的pH
C.滴定管洗净后,经蒸馏水润洗后注入标准液进行滴定
D.向20mL煮沸的蒸馏水中滴加FeCl3饱和溶液1-2mL,继续煮沸1-2分钟,待溶液呈红褐色即得Fe(OH)3胶体
E.用浓氨水洗涤做过银镜反应的试管
F.除去苯中的少量的苯酚,加足量的氢氧化钠溶液,然后分液
G.用水鉴别苯、甘油和硝基苯三种无色液体
H.配制氯化亚铁溶液时,需加少量盐酸及铁粉;
I.用10mL量筒量取5.80mL盐酸
J.可用过滤法除去氧氢化铁胶体中少量的氯化铁和盐酸。
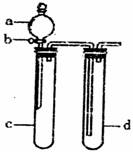
II.(9分)如下图所示:A、B试管中装满NaOH 溶液,X、Y为惰性电极,a、b为电池的两极,关闭K2断开K1后 A、B试管中的现象如图中所示。回答下列问题:
①.关闭K2 断开K1后Y的电极反应为 ,X电极的名称为
。NaOH溶液的PH变 (填大、小或不变)
②.断开K2关闭K1后Y电极名称为 X的电极反应为
13.某一元素位于周期表中第三周期,它的某一同位素原子的质量数为A 质子数为Z ,则该原子的中子数与最外层电子数的比为 ( )
A.A/Z B.(A-Z)/Z
C.(A-Z)/(Z-8) D.(A-Z)/(Z-10)
第Ⅱ卷 非选择题
12.将稀醋酸钠溶液加热,下列叙述正确的是 ( )
A.水的离子积不变、PH变小、呈酸性
B.c(CH3COO-)浓度变小、PH变大、呈碱性
C.c(CH3COO-)浓度不变、PH变大、呈酸性
D.c(Na+)= c(CH3COO-)
11.在常温下,下列在指定溶液中的各组离子,能够大量共存是 ( )
A.无色溶液中:HCO3-、Na+、Cl-、OH-
B.pH=11的溶液中:S2-、K+、CO32-、Cl-
C.pH=1的溶液中:Fe2+、NH4+、Mg2+、NO3-
D.水电离的c(H+)=10-12mol·L-1的溶液中:Fe3+、SO42-、K+、SCN-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com