
30.(16分)某校化学小组同学设计以下装置,进行不同的实验。其中a为用于鼓入空气的气囊,b为铜丝螺旋,c为喷有少量碱液的棉花,d中盛有冰水。
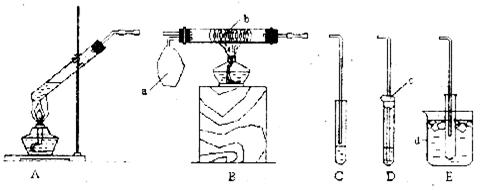
(1)若用A装置做乙醇与乙酸酯化反应的实验,则还需连接的仪器是(填装置编号) ,该仪器中应加入的试剂是 。要加快酯化反应的速率,通常采用的措施是 。写出含18O的乙醇与乙酸反应的化学方程式
。
(2)该小组同学欲做浓硫酸与铜反应的实验,并检验产生的二氧化硫气体,他们应选用的装置是 ,用于检验产物二氧化硫可选用的试剂是 。在所选装置中 (填有关字母)部分是为了减少二氧化硫对空气的污染,相应的离子方程式为 。
(3)该小组同学欲做乙醇氧化成乙醛的实验,他们可选用的装置是 (填装置编号)。
(4)该小组同学欲用A装置做铜与浓硝酸反应的实验,请你判断该实验是否可行 (填“是”或“否”),若不可行,对装置的改进措施是 (若认为可行,此问可不答)。
[选做部分]
29.(12分)t℃时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应: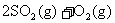

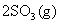 ;△H=-196kJ·mol一1。2min时反应达到化学平衡,此时测得反应放出的热量为39.2 kJ。请填写下列空白:
;△H=-196kJ·mol一1。2min时反应达到化学平衡,此时测得反应放出的热量为39.2 kJ。请填写下列空白:
(1)下列叙述能证明该反应已经达到化学平衡状态的是(填标号;下同)
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生交化 D.容器内气体密度不再发生变化
(2)从反应开始至达到化学平衡,生成SO3平均反应速率为 ;平衡时混合气体中SO3的物质的量分数为 。
(3)反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是
A.向容器中通入少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气
(4)上述反应达平衡后,判断下列情况下平衡移动的方向(填“向右”、“向左”或“不”).
①再通入1.6molSO2、0.8molO2、0.4molSO3,
②再通入0.2molSO2、0.2molSO3,
28.(14分)Ⅰ.(7分)在A、B、C、D、E五种短周期元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比为1:1或2:1形成化合物,但常温时A、B形成化合物与C、B形成化合物的状态不同。D的原子最外层电子数最多,E的核电荷数最大,D与E能形成气态物质ED4。
(1)画出D的原子结构示意图 ,五种元素原子半径从大到小的顺序是
(用A、B、C、D、E表示)
(2)C与D形成的化合物水溶液显 (填酸性、碱性或中性),其原因是(用离子方程式表示) 。
(3)D、E所形成氢化物的稳定性由强到弱的顺序是 (用化学式表示)。
(4)由短周期元素组成的微粒,如SO2、O3、NO2一可互称为等电子体,则与B、D同周期元素组成的微粒中,能与N3一、CS2互称为等电子体的微粒的化学式是 写出两种)。
Ⅱ.(7分)A、B、C是三种短周期元素的单质,甲、乙是两种常见的化合物,这些单质、化合物之间存在如下图所示关系(反应条件均未注明).回答下列问题:

下列(1)-(3)中的A不在同一主族。
(1)若A为ⅢA族元素,则A是 ,B是 ,C是 。
(2)若化合物乙为氧化物,则单质A与化合物甲反应的化学方程式为:
。
(3)若化合物甲在常温,常压下为液态,则单质A与化合物甲反应的化学方程式为:
。
15.下图是Ca(OH)2的溶解度曲线示意图。20℃时,取两份等质量的饱和石灰水,一份加少量生石灰,恢复至室温得到溶液①;另一份升温至50℃,得到溶液②。溶液①与溶液②相比,下列说法正确的是

A.c(Ca2+):①>②
B.溶解度:①<②
C.Ca(OH)2的质量分数:①<②
D.pH:①=②
第Ⅱ卷(非选择题,必做120分+选做32分,共152分)
第Ⅱ卷共16个小题。其中23-30题为必做题,31-38题为选做题。考生必须从选做题中选择2个物理、1个化学和1个生物题作答。
[必做部分]
14.常温下,下列有关离子浓度及pH大小的比较,正确的是
A.NH4+浓度相同的下列溶液:①(NH4)2 Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序是;③>②>①
B.由pH=3的HAc与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:
[Ac一]>[Na+]>[H+]>[OH一]
C.pH=13的Ba(OH)2与pH=1的HCl溶液等体积混合后,混合溶液的pH>7
D.pH=12的Ba(OH)2与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是: 13<pH<14
13.如下图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成;一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转,说明此时该装置形成了原电池,关于该原电池的叙述正确的是
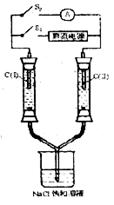
A.C(Ⅰ)的电极反应式是2H++2e一=H2↑
B.C(Ⅱ)的电极反应式是Cl2+2e一=2Cl一
C.C(Ⅰ)的电极名称是阴极
D.C(Ⅱ)的电极名称是负极
12.下列有关说法中正确的是
A.Fe2O3与足量HI溶液反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O
B.向含有NO3一、SiO32一、[Al(OH)4]一、S2一四种阴离子的溶液中加入过量的盐酸,微热并搅拌后,再加入过量NaOH溶液,充分反应后,溶液中大量减少的离子为SiO32一、S2一
C.在反应 中氢化产物与还原产物的质量比为1:2.
中氢化产物与还原产物的质量比为1:2.
D.在NaHSO4溶液中存在如下关系:c(H+)=c(OH一)十c(SO42一)
11.设NA表示阿伏加德罗常数,下列有关叙述不正确的是
A.6.4gCu在与足量硫单质反应时,共失去电子为0.2NA
B.含0.01mol FeCl3的饱和溶液制成的氢氧化铁胶体中所含胶粒数小于0.01 NA
C.常温常压下,NA个氢分子的体积大于22.4L
D.1 mol D3O+所含的电子数为10 NA
10.用下图表示的一些物质或概念间的从属或包含关系中不正确的
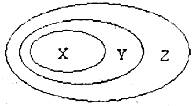
|
|
X |
Y |
Z |
|
例 |
氧化物 |
化合物 |
纯净物 |
|
A |
苯 |
芳香烃 |
有机化合物 |
|
B |
强电解质 |
电解质 |
化合物 |
|
C |
溶液 |
分散系 |
混合物 |
|
D |
置换反应 |
氧化还原反应 |
离子反应 |
9.下列有关说法正确的是
A.淀粉、蛋白质、脂肪都是营养物质,都属于高分子化合物
B.为了增强漂白效果,可将二氧化硫和漂白粉混合使用
C.通常所用生理盐水的浓度为0.9%
D.静电除尘是利用了胶体能发生丁达尔现象的性质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com