
13.在100mL 0.1mol ·L-1的AgNO3溶液中加入100mL溶有2.08gBaC12的溶液,再加入100 mL溶有0.01molCuSO4·5H2O的溶液,充分反应。下列说法中正确的是 ( )
A.最终得到白色沉淀和无色溶液
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物
C.在最终得到的溶液中,C1-的物质的量为0.02mol
D.在最终得到的溶液中,Cu2+的物质的量浓度为0.01mol·L-、1
12.常温下,下列有关叙述正确的是 ( )
A.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1
B.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C.pH相等的①NH4C1、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①=②>③
D.10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V (总)=20mL
11.最近媒体报道了一些化学物质,如:爆炸力极强的N5、比黄金还贵的18O2、太空中的甲醇气团等。下列说法中,正确的是 ( )
A.18O2和16O2是两种不同的核素
B.将ag铜丝灼烧成黑我后趁热插入甲醇中,铜丝变红,质量小于ag
C.CH3OH与CH3CO18OH发生反应的化学方程式为:
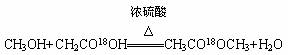
D.2N5=5N2是化学变化
10.下列反应的离子方程式错误的是 ( )
A.向碳酸氢钙溶液中加入少量氢氧化钠溶液
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B.等体积物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3·H2O+H2O
C.氢氧化铝与足量盐酸反应:
A1(OH)3+3H+=A13++3H2O
D.过量的CO2通入氢氧化钠溶液中CO2+OH-=HCO3-
9.下列是有关实验的叙述中,合理的是 ( )
①用pH试纸测得氯水的pH为2
②不宜用瓷坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤干净
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤向沸腾的NaOH稀溶液中滴加氯化铁饱和溶液,可以制得氢氧化铁胶体
⑥实验室酸制氯化亚锡溶液时,可以先将氯化亚锡溶解在盐酸中,再配制到所需要的浓度
A.①②④ B.②③⑥ C.②④⑥ D.②③④⑤⑥
33.(8分)[ 化学一有机化学基础]
肉桂醛(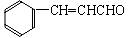 )在自然界中存在于桂油中,是一种常用的植物
)在自然界中存在于桂油中,是一种常用的植物
调味油,工业主要用CH2= CH2和甲苯为主要原料进行合成:
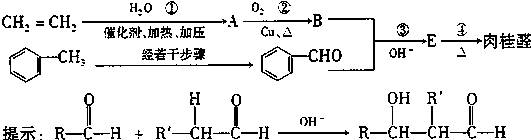
请回答:
(1)E中含氧官能团的名称是 。
(2)反应①-④中属于加成反应的是 。
(3)反应②的化学方程式是 。
(4)写出符合下列要求的E的同分异构体的结构简式(写出一种即可) 。
a.遇 FeCl3溶液显紫色 b.苯环上有两个取代基
c.不能发生银镜反应 d.除苯环外不存在其它的环状结构
e.不存在C=C
(5)用流程图表示出由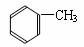 制备
制备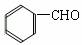 的方案,例如:
的方案,例如:
。
32.(8分)[ 化学一物质结构与性质]
请完成下列各题:
(1)前4周期中,基态原子中未成对电子数为4的元素原子的电子排布式为
。
(2)NaCl晶体中,与Na+等距离且最近的Na+有 个。
(3)N 原子的第一电离能 (填 “>”、“<” 或“=”)O原子的第一电离能,
N2分子中存在 个σ键和 个π键,NH3的沸点比PH3 (填“高”或“低”)NH4+ 中N原子的杂化方式为 ,NH4+的空间构型为 。
31.(8分)[化学一化学与技术](本模块因我市未选,故未命题 )
30.(17分)纯度测定是化学实验中经常碰到的问题,结合实验原理和实验用品,纯度测定可有多种选择。
(1)工业纯碱中含少量NaCl,若实验室只提供盐酸、天平、蒸发皿、玻璃棒、铁架台(带铁夹、铁圈),请设计一个方案,测定纯碱样品的纯度。
。
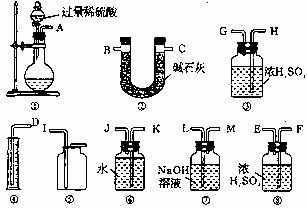
(2)过碳酸钠(Na2CO4)中含有少量Na2O2,已知:2Na2CO4 +2H2SO4 = 2Na2SO4 +2CO2 ↑ + O2 ↑ +2H2O为测定其纯度,甲、乙两位同学各称取m g该样品选用下列图示仪器药品进行实验,甲的仪器连接顺序是①⑦③⑥④ , 乙同学是①②。
请回答下列问题:
①甲同学想通过实验测得的数据是 ,他使用装置③ (填“有”或“没有”)必要。
②乙同学想测得的数据是 。
③考虑到装置①中的水蒸气和空气中的水蒸气都会被装置②吸收,按乙测得的数据计算出的结果不准确,为此,请你帮助乙同学将实验装置进行改进,要求只能选用上列仪器,且每种仪器最多只能使用一次,写出各仪器接口的连接顺序
。
④按你设计的实验装置进行实验,若所得实验前后装置②的质量分别是w1g和w2g,则样品中过碳酸钠的质量分数为 。
⑤由于受到仪器的限制,你帮乙改进后的装置所测得的过碳酸钠的质量分数仍稍偏低, 其原因是 。
[选做部分]
共8个题,考生从中选择2个物理题、1个化学题和1个生物题作答。
29.(13分)铁是应用最广泛的金属,工业上常采用热还原法制备铁。
(1)工业高炉炼铁采用焦炭、铁矿石等于高炉中共热,并鼓入适量空气,让高温下产生的CO气体还原铁矿石制得铁。这种方法不可避免地混入了非金属单质-碳。纯铁的抗腐蚀能力相当强,而铁碳合金却易发生电化腐蚀。
①写出钢铁发生吸氧腐蚀时的正极反应 。
②为保护钢铁制品不被腐蚀,可采用的电化学防护方法是(答出一种电化学防护方法的名称) 。
(2)焊接无缝钢轨时常采用铝热反应制备铁,中学教材中也有Al和Fe2O3的铝热反应实验。
①有人推测,铝热反应实验中所得熔融物中可能混有Al。若用一个简单实验证明含Al,则应选用的试剂是 ,能证明含铝的现象是
。
②若经实验证实熔融物含铝,欲将该熔融物完全溶解,下列试剂中最适宜的是
(填序号)
A.浓硫酸 B.稀硫酸 C.稀HNO3 D.NaOH溶液
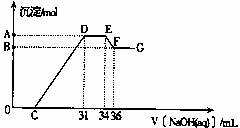
③实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,直到还原成铵根离子 (NH4+)。某同学取一定量熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入4mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL) 与产生沉淀的物质的量(mol)的关系如图所示:
试回答下列问题:
I.图中DE段沉淀的物质的量没有变化,此段发生反应的离子方程式为
。
Ⅱ.通过图象判断溶液中的离子结合OH-能力最强的是 最弱的是
。
Ⅲ.EF段反应的离子方程式是 A与B 的差值是 mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com