
2.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构。下面有关13C、15N叙述正确的是
A.13C与15N有相同的中子数 B.13C与C60互为同素异形体
C.15N与14N互为同位素 D.15N的核外电子数与中子数相同
1.下列有关环境问题的说法不正确的是
A.燃煤时加入适量石灰石,可减少废气中SO2的含量
B.减少直至不使用氟氯烃可防止对大气臭氧层的破坏
C.pH>5.6的降水通常称为酸雨
D.大量使用含磷合成洗涤剂会导致水体污染
33.(8分)[化学--有机化学基础]
下列框图中A、F、G、H都是芳香族化合物。A的相对分子质量不超过200,完全燃烧只生成CO2和H2O;A中氧元素的质量分数为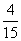 。
。
又已知:①G、E均能发生银镜反应;②F与NaHCO3溶液反应能产生气体。③C的溶液被称为福尔马林。
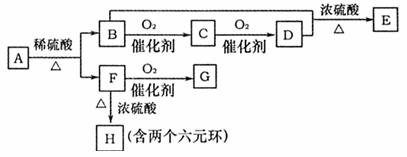
回答下列问题:
(1)E产生的核磁共振氢谱图上有 种峰。
(2)C和苯酚反应生成酚醛树脂的反应类型为(选填序号) 。
①消去反应 ②取代反应 ③加成反应 ④缩聚反应
(3)一个A的分子中应有 个(选填2、3、4……等)氧原子。
(4)由F生成H的化学方程式为 。
(5)H的同分异构体甚多。请写出符合下列条件的同分异构体的结构简式(任写两种):①苯环上只有一个取代基;②能够与NaOH溶液反应。
。
32.(8分)[化学--物质结构与性质]
下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
(1)请写出下图中d单质对应元素原子的电子排布式 。
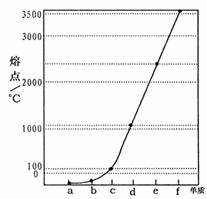
(2)单质a、f对应的元素以原子个数比1:1形成的分子(相同条件下对H2的相对密度为13)中含
个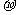 键和
个
键和
个 键。
键。
(3)a与b的元素形成的10电子中性分子X的空间构型为 ;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到配合物的化学式为 ,其中X与Ag+之间以 键结合。
(4)下图是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的原因 。
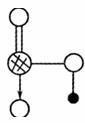
31.(8分)[化学--化学与技术](本模块不命题)
30.(16分)某校甲、乙、丙三个化学兴趣小组利用课外活动时间,设计了不同的课题分别进行了实验探究活动:
(1)甲小组进行中和滴定实验,实验室里只提供了下面几种仪器:酸式滴定管、碱式滴定管、量筒、托盘天平、普通漏斗、玻璃棒、烧杯,你认为还缺少的玻璃仪器是 。
(2)乙小组设计了如图所示的一套实验装置,以控究该装置的多功能性。
①李明同学认为该装置可以用来制取、收集SO2气体,其中III中盛有NaOH溶液。乙小组同学经过讲座后认为该装置存在安全隐患,需要将III进行改装,请将改装后的装置图画在方框内。
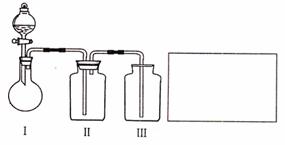
②王强同学认为可利用该装置快速制取、净化、收集氨气,其中II中盛有浓H2SO4。你认为是否正确,若正确则不需做答;若不正确,提出改进意见: 。
(3)丙小组进入了一家回收含铜电缆废料的工厂做社会调查,技术员向同学们展示了两个处理方案,并向同学们提出了下列问题:
方案1:
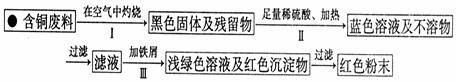
方案2:

①你认为方案 更符合当前绿色生产理念。
②写出方案1中步骤Ⅱ反应的离子方程式 。
③技术员指出,无论是方案1还是方案2,都应加入稍过量的铁屑并最终除去,请你设计除去铁屑的操作方法 。
④为了增加经济效益,该工厂把最后一步所得浅绿色溶液,通过 、冷却结晶、过滤、洗涤、自然干燥得到一种俗称“绿矾”的工业产品。
⑤丙组同学经查询资料,研究、讨论,又设计了方案3,即把方案2中“加入足量稀硫酸、通入空气并加热”改为“加入足量稀硫酸和H2O2”,也可以得到同样的结果。该反应的化学方程式是 。
[选做部分]
共8个题,考生从中选择2个物理题、1个化学题和1个生物题作答。
29.(14分)下图每一方框中的字母代表一种反应物或生成物。

(1)若X由M、N两种短周期且同周期元素形成 ,M原子的最外层电子数是最内层电子数的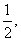 N元素最高正价与它的负价代数和为6。
N元素最高正价与它的负价代数和为6。
①写出反应Ⅱ的离子方程式 。
②右图为IV达到平衡后改变反应条件,反应速率随时间变化的情况,已知t2-t3阶段为便用催化剂;t3-t4阶段为减小体系的压强,写出符合上述条件的化学方程式
(写一个即可,用具体物质表示);若t4-t5阶段为升高体系的温度,则该反应为 (填“放热”或“吸热”)
③某温度下,四个容器中均进行着上述反应,各物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
|
容器编号 |
C(C)/mol·L-1 |
C(D)/mol·L-1 |
C(G)/mol·L-1 |
V正、V逆比较 |
|
甲 |
0.06 |
0.60 |
0.60 |
V正=V逆 |
|
乙 |
0.6 |
0.50 |
0.40 |
|
|
丙 |
0.12 |
0.40 |
0.80 |
V正<V逆 |
|
丁 |
0.12 |
0.30 |
|
V正=V逆 |
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应Ⅱ需要B与A的浓溶液共热才能进行,且生成的E与G是同一种物质。写出反应Ⅰ的化学方程式 ;4g固态D在C中完全反应放出37.2kJ的热量,写出该反应的热化学方程式 。

28.(12分)现有aA、bB、cC、dD、eE、fF六种短周期元素,原子序数依次增大,A、B、C、D都是生命不可缺少的重要元素。已知它们原子序数存在如下关系:a+b=c, a+c=d, b+c=f;元素A、B、C和D都能形成原子个数比为1:1和1:2的化合物;元素E的原子是短周期主族元素中原子半径最大的原子。其中由A、B、D三元素组成的化合物甲,其化学式灾BA4D;由D、E两元素形成原子个数比为1:1化合物乙;C的气态氢化物和最高价氧化物的水化物分别为丙和丁。请根据要求回答下列问题:
(1)经测定,A2D2的水溶液呈弱酸性。请写出第一步的电离方程式 。
(2)用甲和单质D2可设计成燃料电池,若电解质溶液为浓KOH溶液,则正极的电极反应式为 。
(3)3.9g乙与足量的水反应,电子转移的物质的量是 。
(4)单质F与E的最高价氧化物的水化物的溶液反应的离子方程式是 。
(5)常温下向25mL 0.1mol·L-1丙溶液中逐滴滴加0.1mol·L-1丁溶液,滴加过程中混合溶液pH的变化曲线如下图所示:
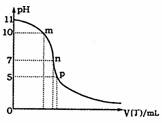
①图中m点由水电离也的OH-的物质的量浓度为 ;
②p点时,丙溶液和丁溶液恰好完全反应,则p点溶液中各备种离子浓度由大到小的顺序为 。
15.为监测空气中汞蒸水气是否超标,通过悬挂涂有Cu1(白色)的滤纸,根据滤纸是否变色(亮黄色至暗红色)及变色所需时间来判断空气中汞含量。发生的化学反应为4Cu1+Hg=Cu2HgI4+2Cu。下列说法不正确的是 ( )
A.反应中转移电子2mol
B.该反应中的氧化剂为CuI
C.该反应被氧化元素是铜元素和汞元素
D.Cu2HgI4既是氧化物又是还原产物
第Ⅱ卷(必做120分+选做32分,共152分)
[必做部分]
14.已知锌及其化合物的性质与铝及其化合物相似。如图,横坐标为溶液的pH,纵坐标为Zn2+离子或[Zn(OH)4]2-离子的物质的量浓度(假设Zn2+离子浓度为10-5mol·L-1时,Zn2+离子已沉淀完全)。下列说法不正确的是 ( )
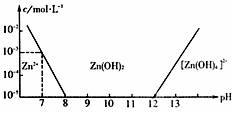
A.往ZnC12溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:Zn2++4OH-=[Zn(OH)4]2-
B.从图中数据计算可得Zn(OH)2的溶度积K sp=10-17mol3·L-3
C.某废液中含Zn2+离子,沉淀Zn2+离子可以控制溶液pH的范围是8-12
D.向1L 1mol·L-1ZnC12溶液中加入NaOH固体至pH=7,需NaOH 2mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com