
12.下列离子方程式书写正确的是
A.NH4Cl、FeCl3混合溶液中加入氨水调节pH=4:Fe3++3OH-=Fe(OH)3↓
B.稀硝酸中加入的铜粉:Cu+4H++2NO3-=Cu2++2NO↑+2H2O
C.1mol/L的NaAlO2溶液和4mol/L的HCl等体积互相均匀混合:AlO2-+4H+=Al3++2H2O
D.盐酸洗涤铜器表面的碱式碳酸铜:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
11.在一密闭的容器中,由一定量的A4(s)和B2(g)反应,可得到AB5(g)和AB3(g)二种产物,生成物在各个温度下的平衡浓度c与温度T的关系如图。下列说法错误的是
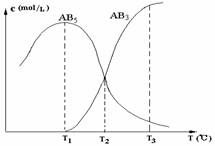
A.AB5(g) AB3(g)+B2(g)其反应的反应热ΔH>0
AB3(g)+B2(g)其反应的反应热ΔH>0
B.A4(s)+10B2(g)  4AB5(g)
其反应的反应热ΔH<0
4AB5(g)
其反应的反应热ΔH<0
C.在T2时刻,保持温度不变,给体系加压,达到新平衡时,n(AB5)>n(AB3)
D.在T1、T2、T3时,容器中B2的物质的量的大小关系为n(B2,T3)>n(B2,T2)>n(B2,T1)
10.25℃时,BaCl2溶液呈中性,溶液中存在平衡:H2O 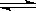 H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A.向溶液中加入稀氨水,平衡逆向移动,c(OH―)降低,Kw不变
B.向溶液中加入少量固体CuSO4,c(H+)增大,Kw不变
C.向溶液中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 ,Kw不变
D.将溶液加热到90℃,Kw增大,溶液仍呈中性,pH不变
9.关于下列粒子的描述不正确的是
A.PH3的电子式为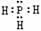 ,其热稳定性不如NH3
,其热稳定性不如NH3
B.HS-的电子式为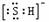 ,是含有极性键的18电子的粒子
,是含有极性键的18电子的粒子
C.CH2Cl2的电子式为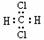 ,是分子结构呈四面体的分子
,是分子结构呈四面体的分子
D.KF的电子式为K+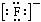 ,它是易溶于水的离子化合物
,它是易溶于水的离子化合物
8.下列各组离子,在指定环境中一定能大量共存的是
A.在pH>7的溶液中,Na+、S2-、K+、AlO2-
B.在由水电离子的c(H+)=1×10-13mol/L的溶液中,SO42-、S2-、K+、NH4+
C.溶解有Na2CO3的溶液中,Al3+、Cu2+、Cl-、NO3-
D.在pH=0的溶液中,Fe2+、ClO-、Na+、SO42-
7.某同学设计一个如图所示(用铅蓄电池做电源)的电化学实验。下列说法正确的是
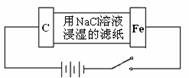
A.电解池的阳极电极反应式:Fe-2e-=Fe2+
B.电解池的阴极电极反应式:2H++2e-=H2↑
C.铅蓄电池的负极的电极反应式:PbO2+4H++SO42-+2e-=PbSO4+2H2O
D.铅蓄电池的负极的电极反应式:Pb-2e-=Pb2+
6.某有机物的分子结构如图(图中棍表示单键、双键或叁键),它属烃或烃的含氧衍生物。关于该有机物的叙述不正确的是
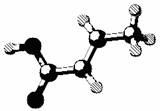
A.该有机物的化学式为C4H6O2
B.该有机物可使溴水褪色,也可与NaOH溶液反应
C.该有机物可发生取代反应和加成反应
D.该有机物是乙酸的同系物
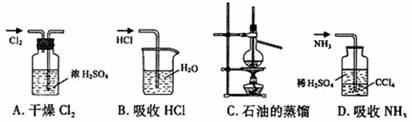
5.用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是
4.对于氧化还原反应:CuSO4+KI -- K2SO4+CuI↓+I2,下列说法正确的是
A.氧化剂和还原剂的物质的量之比1:2
B.1mol氧化剂在反应中得到的电子1mol
C.氧化产物与还原产物的物质的量之比为2:1
D.该反应的离子方程式Cu2++3I-=CuI↓+I2
3.NA表示阿伏加德罗常数,下列说法中正确的是
A.3.6g D2O中所含质子数为2NA
B.1mol FeBr2与足量的Cl2反应转移2NA个电子
C.1molNH3分子中共价键总数为3NA
D.4.48 L N2和O2的混合气体所含分子数为0.2NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com