
7.下列选项中各种物质均能使溴水、酸性KMnO4溶液褪色的一组物质是 ( )
A.CO、H2、SO2、H2S B.H2S、SO2、H2Se、SeO2
C.CO、SO3、HCl、H2Se D.H2Se、SeO2、H2、HI
6.A、B、C、D、E是同一周期的五种主族元素,A和B最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子数由小到大的顺序是 ( )
A.A、B、C、D、E B.E、C、D、B、A
C.B、A、D、C、E D.C、D、A、B、E
5.铋(Bi)在医药方面有重要应用。下列关于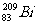 和
和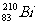 的说法正确的是 ( )
的说法正确的是 ( )
A.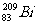 和
和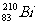 都有83个中子 B.
都有83个中子 B.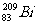 和
和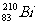 互为同素异形体
互为同素异形体
C.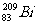 和
和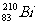 的核外电子数不同 D.
的核外电子数不同 D.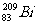 和
和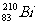 分别含有126和127个中子
分别含有126和127个中子
4.设NA代表阿伏加德罗常数,以下说法正确的是 ( )
A.在标准状况下,22.4L SO3和SO2所含分子数均为NA
B.1mol Na2O2与足量的水反应转移电子数为2NA
C.1mol S与足量的铜反应转移电子数为2NA
D.1mol铁与足量的氯气反应转移电子数为2NA
3.X、Y两种元素的原子的质子数之和为20,两元素形式的化合物在水溶液中能电离出电子层结构相同的阴离子,则X、Y形成的化合物是 ( )
A.MgF2 B.NaF C.LiCl D.Na2O
2.下列实验操作中:①过滤 ②蒸发 ③溶解 ④取液体试剂 ⑤取固体试剂,一定要用到玻璃棒的是 ( )
A.①②③ B.④⑤ C.①④ D.①③
1.原子结构模型的演变图中,(1)为道尔顿实心球式原子模型、(2)为卢瑟福带核的原子模型、(3)为汤姆生葡萄干面包式原子模型、(4)为玻尔轨道式原子模型。其中符合历史演变顺序的一组排列是 ( )

A.(1)(3)(2)(4) B.(1)(2)(3)(4)
C.(1)(4)(3)(2) D.(1)(3)(4)(2)
1.原子核对核外电子的吸引力 2.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
|
|
锂 |
X |
Y |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7296 |
4570 |
1820 |
|
失去第三个电子 |
11799 |
6920 |
2750 |
|
失去第四个电子 |
|
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。 。
②表中X可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j形成化合物的化学式 。
③Y是周期表中 族元素。
④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多
C.(有机化学基础)烃A在一定条件下可以按以下路线进行反应:
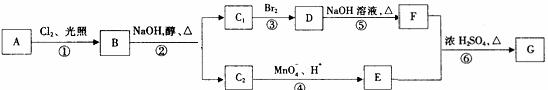
其中C1和C2互为同分异构体,C2的结构简式为 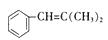 ,G的分子式为C24H22O4。
,G的分子式为C24H22O4。
请回答:
(1)上述反应中,属于取代反应的有(填反应序号) 。
(2)下列有机物的结构简式分别为:
B: ,D: 。
(3)反应①的化学方程式为 。
(4) 反应⑥的化学方程式为 。
31.化学选考题(15分)
A.(化学与技术)氨是最重要的氮肥,是产量最大的化工产品之一,其合成原理为N2(g)+3H2(g) 2NH3(g) △H=-92.4KJ/moL。试回答下列问题:
2NH3(g) △H=-92.4KJ/moL。试回答下列问题:
氨的合成是一个可逆反应,为了探索合成氨的最佳条件,人们进行了大量的研究。
(1) 下列有关做法不适宜的是( )
A、常采用循环法,使未转化的氮气和氢气得到充分的利用。
B 、综合考虑各方面的因素,压强控制在20-50MPa之间为宜
C、利用电解水制氢气,作为合成氨的原料,
D 、使用铁触媒为催化剂,在5000C时获得最大催化效益。
(2)合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)
A 、采用较高压强(20-50MPa)
B、采用5000C的高温
C、用铁触媒为催化剂
D、将生产的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
(3) 在298K时,将10moL N2和30moL H2放入合成塔中,为何放出的热量小于924KJ?
(4) 怎样知道在合成氨工业有氨气生成?
如果提高单位时间内氨气的产量,对温度而言,在 (填高温或低温)下有利.
B.(物质结构与性质)(15分下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
|
b |
|
|
|||||||||||||||
|
|
|
|
|
h |
|
j |
|
|
|||||||||
|
a |
c |
f |
|
i |
|
l |
m |
||||||||||
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
g |
|
|
|
|
|
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、1 ④d、e、m
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
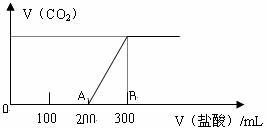
27. (13分)向100 mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应后,测得最后溶液的PH>7。
(1)由下图分析,最后溶液中的溶质为 物质的量分别为 moL moL(4分)
(2)在上述所得溶液中,逐滴缓慢滴加1mol/L的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
① 加入盐酸200mL之前,无气体产生,写出OA段发生反应的离子方程式:
、 (4分)
② 产生的CO2气体的最大体积在标况下的体积为 mL(2分)
③B点时,反应所得溶液中溶质的物质的量浓度是 mol/L (3分)
(体积的变化忽略不计)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com