
6.下列离子方程式正确的是:
A.H2O2+2OH-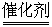 2H2O+O2↑
2H2O+O2↑
B.Cl2+6OH- ClO3-+5Cl-+3H2O
ClO3-+5Cl-+3H2O
C.2MnO4-+H2O2+6H+=2Mn2++3O2↑+4H2O
D.3MnO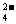 +4H+=2MnO
+4H+=2MnO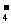 +MnO2↓+2H2O
+MnO2↓+2H2O
5.设NA为阿伏加德罗常数,下列说法正确的是:
A.标准状况下,5.6L四氯化碳含有的分子数为0.25NA
B.标准状况下,14g氮气含有的核外电子数为5NA
C.标准状况下,22.4L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D.标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA
4.锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为:
A.2mol B.1 mol C.0.5mol D.0.25mol
3.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是:
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
2.用pH试纸测定溶液pH的正确操作是:
A.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
B.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
C.将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
D.将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照
1.HBr分子的电子式为:
A.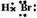 B.H+Br-
C.
B.H+Br-
C. 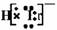 D.H-Br
D.H-Br
29.(18分)硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为FeSO4·(NH4)2SO4
·6H2O。硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了。硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得。三种盐的溶解度(单位为g/100g水)如下表:
|
温度/℃ |
10 |
20 |
30 |
40 |
50 |
70 |
|
(NH4)2SO4 |
73.0 |
75.4 |
78.0 |
81.0 |
84.5 |
91.9 |
|
FeSO4·7H2O |
40.0 |
48.0 |
60.0 |
73.3 |
- |
- |
|
摩尔盐 |
18.1 |
21.2 |
24.5 |
27.9 |
31.3 |
38.5 |
下图是模拟工业制备硫酸亚铁铵晶体的实验装置。
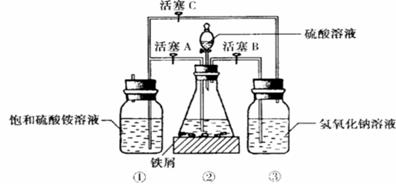
回答下列问题:
Ⅰ.
(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS等),再用清水洗净。用氢氧化钠溶液煮沸的目的是_____________________________________
(2)将处理好的铁屑放人锥形瓶中,加入稀硫酸。锥形瓶中发生反应的离子方程式可能为______________(填序号)。
A.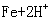 ===
=== ↑ B.
↑ B.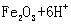 ===
===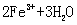
C.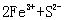 ===
=== 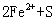 ↓ D.
↓ D.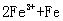 ===
===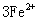
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞______,打开活塞_____ (填字母)。容器③中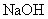 溶液的作用是_________________________________;向容器①中通人氢气的目的是_____________________________________________。
溶液的作用是_________________________________;向容器①中通人氢气的目的是_____________________________________________。
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部。在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。
硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是______________;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是________、_____ 、___________。
Ⅲ.制得的硫酸亚铁铵晶体中往往含有极少量的Fe3+。为测定晶体中Fe2+的含量,称取一份质量为20.0 g的硫酸亚铁铵晶体样品,制成溶液。用0.5 mo1·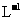 KMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO-4被还原成Mn2+时,耗KMnO4溶液体积20.00mL。
KMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO-4被还原成Mn2+时,耗KMnO4溶液体积20.00mL。
滴定时,将KMnO4溶液装在____________(酸式或碱式)滴定管中,判断反应到达滴定终点的现象为_________ _____;晶体中FeSO4的质量分数为_________。
28.(15分)有机物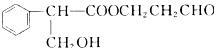 在稀硫酸中受热会生成M、N两种产物,其中M为芳香族化合物。
在稀硫酸中受热会生成M、N两种产物,其中M为芳香族化合物。
(1)写出M的结构简式____________________,该反应属于________________反应。
(2)已知:
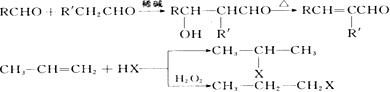
工业上利用上述信息,按下列路线合成M和一种香料W(C9H10O)。
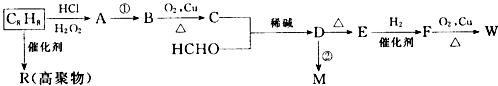
I.C8H8的结构简式为___________________________________。
Ⅱ.反应①的化学方程式为__________________________________________;
(有机物写结构简式,并注明反应条件,下同)
反应②的化学方程式为______________________________________________。
Ⅲ.香料W的结构简式为_______________。W有多种同分异构体,其中:1)分子中有苯环,且苯环上的一溴代物有两种;2)其水溶液遇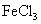 溶液呈紫色。则其可能的结构简式为(写两种):
溶液呈紫色。则其可能的结构简式为(写两种):
_____________________________________________________________________。
(3)以N和甲醇为原料,其它无机试剂任选,写出制备一种性能优良,装饰性能好的高分子涂料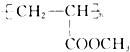 的合理流程图,并注明试剂和条件。
的合理流程图,并注明试剂和条件。
例如:
___________________________________________________________________
27.(15分)已知a、b、I、K四种粒子都有10个电子,其结构特征如下:
A可作为工业上生产酸J的原料,B、C为非金属单质,E为红棕色固体,物质D由a、b构成,G是一种消毒剂的主要成分。各物质之间的转化关系如下图所示(个别产物略去)。
请回答下列问题:
(1)考虑到综合经济效益,工业生产K时,可采取的措施有___________ (填序号)。
a.使用催化剂 b.适当降低温度
c.适当增大压强 d.及时分离出产物
e.对原料进行循环利用 f.充分利用反应本身放出的热量
g.工厂地址选择在交通发达的大城市
(2)写出反应②的离子方程式:________________________________________。
(3)反应④中,G(溶液)与K能以物质的量之比为1:2反应生成L、H、I。L是一种火箭燃料,其分子中各原子均已达稳定结构。则L的电子式为___________,该反应的化学方程式为________________________________________________。
(4)将F通入含等物质的量的D的溶液中,反应后的溶液能使甲基橙显红色,则此溶液中各微粒浓度的守恒关系是________________________________ (只写一种)。
(5)工业上反应①应在__________(填设备名称)中进行。现有1 mol A参加反应,假设各步均反应完全,生成M的质量为1165g,生成E的质量为320g,则反应①的化学反应方程式为_____________________________________________。
26.(12分)化合物A、B、C、D、E分别由 、
、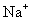 、
、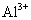 、
、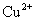 四种阳离子和
四种阳离子和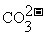 、
、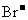 、
、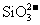 、
、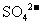 四种阴离子组成。 已知:①A、B、C三种溶液pH<7,D、E溶液pH>7 ②A、C的阴离子相同,D、E的阳离子相同 ③用石墨电极电解A的溶液,阳极有无色气体产生,阴极有红色物质生成 ④C溶液与D溶液反应能生成一种白色沉淀和一种气体,且此沉淀可溶于B的溶液,此气体通如E的溶液中可产生另一种白色沉淀。
四种阴离子组成。 已知:①A、B、C三种溶液pH<7,D、E溶液pH>7 ②A、C的阴离子相同,D、E的阳离子相同 ③用石墨电极电解A的溶液,阳极有无色气体产生,阴极有红色物质生成 ④C溶液与D溶液反应能生成一种白色沉淀和一种气体,且此沉淀可溶于B的溶液,此气体通如E的溶液中可产生另一种白色沉淀。
请根据以上事实填空:
(1)写出B、C、E的化学式:B___________、C___________、E____________。
(2)D溶液的pH>7,原因是:_________________________________________。
(3)写出C溶液与D溶液发生反应的离子方程式:_______________________。
(4)若用石墨电极电解400mL,1.0 mo1·L-1 A的溶液,当阳极有2.24 L气体(标准状况)产生时,溶液的pH=_______________ (设溶液的体积不变)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com