
26.(A)如上图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题:
|
实验序号 |
甲针筒内物质 |
乙针筒内物质 |
甲针筒的现象 |
|
1 |
10mLFeSO4溶液 |
10mLNH3 |
生成白色沉淀,后变色 |
|
2 |
20mLH2S |
10mLSO2 |
|
|
3 |
30mLNO2(主要) |
10mLH2O(l) |
剩有无色气体,活 塞自动向内压缩 |
|
4 |
15molCl2 |
40mLNH3 |
|
⑴实验1中,沉淀最终变为 色,写出沉淀变色的化学方程式 。
⑵实验2甲针筒内的现象是:有 生成,活塞 移动(填向外、向内、不)。
反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入 溶液中。
⑶实验3中,甲中的30mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是 ,写出NO2与H2O反应的化学方程式 。
⑷实验4中,已知:3Cl2+2NH3→N2+6HCl。甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为 ,最后针筒中剩余气体的体积约为 mL。
25.在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.01. |
0.008 |
0.007 |
0.007 |
0.007 |
⑴写出该反应的平衡常数表达式:K= 。
已知: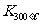 >
>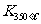 ,则改反应是 热反应。
,则改反应是 热反应。
⑵下图中表示NO2的变化的曲线是 。用O2表示从0~2s内该反应的平均速率v= 。
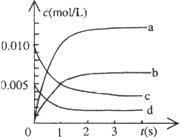
⑶能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正 (O2) d.容器内密度保持不变
⑷ 为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
24.某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
⑴请将Au2O3之外的反应物与生成物分别填如以下空格内。

⑵反应中,被还原的元素是 ,还原剂是 。
⑶将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。

⑷纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
室温下单质呈粉末状固体,加热易熔化。 单质在空气中燃烧,发出明亮的蓝紫色火焰。 |
单质常温、常压下是气体,能溶于水。 原子的M层有1个未成对的p电子。 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
原子最外层电子层上s电子数等于p电子数。 单质为空间网状晶体,具有很高的熔、沸点。 |
⑴B元素在周期表中的位置 ,写出A原子的电子排布式 。
⑵写出C单质与水反应的化学方程 。
A与C形成的化合物溶于水后,溶液的pH 7(填“大于”、“等于”或“小于”)。
⑶D元素最高价氧化物晶体的硬度 (填“大于”、“小”),其理由是 。
⑷A、B两元素非金属性较强的是(写元素符号) 。写出证明这一结论的一个实验事实 。
23.(B)元素A-D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
单质制成的高压灯,发出的黄光透雾力强、射程远。 |
工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构。 |
单质常温、常压下是气体,原子的L层有一个未成对的p电子。 |
+2价阳离子的核外电子排布与氖原子相同。 |
⑴上表中与A属于同一周期的元素是 ,写出D离子的电子排布式 。
⑵D和C形成的化合物属于 晶体。
写出C单质与水反应的化学方程式 。
⑶对元素B的单质或化合物描述正确的是 。
a. B元素的最高正价为+6
b. 常温、常压下单质难溶于水
c. 单质分子中含有18个电子
d. 在一定条件下镁条能与单质B反应
⑷A和D量元素金属性较强的是(写元素符号) 。写出能证明该结论的一个实验事实
。
22.在石灰窑中烧制生石灰,1molCaCO3完全分解所需要的能量,可燃烧0.453mol碳来提供。设空气中O2体积分数为0.21,N2为0.79,则石灰窑产生的气体中CO2的体积分数可能是
A.0.43 B.0.46 C.0.49 D.0.52
第Ⅱ卷(共84分)
21.等质量的铁与过量的盐酸在不同的试验条件下进行反应,测定在不同时间t产生氢气体积v的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的试验组别可能是
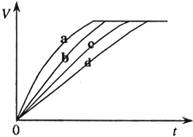
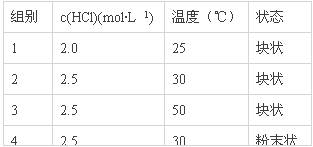
A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3
20.下列离子方程式书写正确的是
A.AgNO3溶液中滴入少量的Na2S溶液 2Ag++S2-→Ag2S↓
B.过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O→HCO3-+HClO
C.向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+→CO2↑+H2O
D.向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-→BaSO3↓+SO32-+2H2O
19.研究发现,空气其中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2
NO2在上述过程中的作用,与H2SO4在下列变化中的作用相似的是
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶 B.硫化氢通入浓H2SO4中
C.浓H2SO4滴入萤石中,加热 D.加入少量H2SO4使乙酸乙酯水解
18.设计学生试验要注意安全、无污染、现象明显。根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(见下图)。若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸出)。下列气体的制取宜使用该装置的是

A.用二氧化锰(粉末)与双氧水制氧气
B.用锌粒与稀硫酸制氢气
C.用硫化亚铁(块状)与盐酸制硫化氢
D.用碳酸钙(块状)与稀硫酸制二氧化碳
17.已知:H2(g)+F2(g)→2HF(g)+270kJ,下列说法正确的是
A.2L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量小于270Kj
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270热量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com