
33.(16分)在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示。
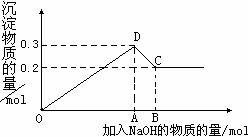
(1)写出代表各线段发生反应的离子方程式:
OD段 ,
CD段 ,
(2)原溶液中Mg2+、Al3+物质的量浓度之比为 。
(3)图中C点表示当加入 mol NaOH时,Al3+已经 ,Mg2+已经 。
(4)图中线段OA∶AB= 。
(5)若得到0.25 mol的沉淀,则加入NaOH物质的量为 。
32.(18分)已知化合物A、D、E、G焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多。E为淡黄色固体,B、F通常条件下为无色的气体 。A~H各物质的变化关系如下图所示。
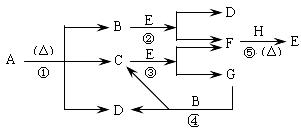
(1)写出各步反应的化学方程式
反应①
反应②
反应③
反应④
反应⑤
(2)上述反应中属于氧化还原反应的有 。
31.(6分)有一瓶存放时间较长的硫酸亚铁,外观上并无明显变化,但某学生怀疑其有部分因氧化而变质,于是取少量硫酸亚铁样品盛于试管,加蒸馏水使之溶解,滴入几滴 溶液,若溶液颜色呈现 ,说明样品有变质,若溶液 ,则未变质。如果该样品变质,应加入 除去变质的杂质,有关的化学方程式为
29.(1993)a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg5种金属中的一种.已知:(1)a、c均能与稀硫酸反应放出气体;(2)b与d的硝酸盐反应,置换出单质d;(3)c与强碱反应放出气体;(4)c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为
A. Fe Cu Al Ag Mg B. Al Cu Mg Ag Fe
C. Mg Cu Al Ag Fe D. Mg Ag Al Cu Fe
30下列生产目的能达到的是
A.AlCl3溶液与Na2S溶液反应制Al2S3
B.用浓H2SO4与溴化钠反应制取溴化氢
C.用铝粉与软锰矿(含MnO2)可制得锰
D.用镁粉和空气反应可制得Mg3N2
第II卷 非选择题(共40分)
28.下列各组物质的溶液中,分别加入足量氨水,观察到的现象相同的是
A. FeCl3, AlCl3 B. NaCl, BaCl2 C. MgCl2, CuCl2 D. FeCl2, FeCl3
27.镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有
A.Cu2+
B.Mg2+ C.Al3+ D. 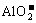
26.向300mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。由于CO2通入量不同,所得到的白色固体不可能的是
A. K2CO3 KOH B. K2CO3 C. K2CO3 KHCO3 D. KOH KHCO3.
24. 甲、乙、丙、丁分别是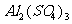 、
、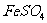 、NaOH、
、NaOH、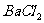 四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是( )
四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是( )
A.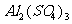 B.NaOH C.
B.NaOH C.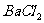 D.
D.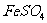
25下列操作中,溶液的颜色不发生变化的是
A.碳酸氢钠溶液中滴加稀盐酸 B.硫酸铁溶液中滴加硫氰化钾溶液
C.铁丝置于氯化铜溶液中一段时间 D.氯化铁溶液中加入还原性铁粉
23. 下列反应的离子方程式书写正确的是
A.钠和冷水反应: Na+2H2O=Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液: Al+2OH-=AlO2-+H2
C.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2
D.铜和硝酸银溶液反应: Cu + 2Ag+ = 2Ag + Cu2+
22.取两份等量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状态下产生的气体体积之比是
A.1:1 B.1:2 C. 1:3 D. 3:2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com