
4、已知常温时红磷比白磷稳定,在下列反应中:
4P(白磷,s)+5O2(g) = 2P2O5(s) △H = -a kJ/mol
4P(红磷,s)+5O2(g) = 2P2O5(s) △H= -b kJ/mol
若a、b均大于零,则a和b的关系为 ( )
A.a<b B.a=b C.a>b D.无法确定
3. 下列热化学方程式中,△H能正确表示物质的燃烧热的是 ( )
A.CO(g) +1/2O2(g) = CO2(g) △H=-283.0 kJ/mol
B. C(s) +1/2O2(g) = CO(g) △H=-110.5 kJ/mol
C. H2(g) +1/2O2(g) = H2O(g) △H=-241.8 kJ/mol
D. C8H18(l) +25O2(g) = 16CO2(g)+18H2O(l); △H=-11036 kJ/mol
2.在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(g) + O2(g) = 2CO2(g)△H =-566 kJ/mol CH4(g) + 2O2(g) = CO2(g) + 2H2O(l)△H =-890 kJ/mol
由1molCO和3molCH4组成的混和气在上述条件下完全燃烧时,释放的热量为 ( )
A.2912kJ B.2953kJ C.3236kJ D.3867kJ
1. 已知 ⑴ H2(g)+1/2 O2(g) = H2O(g) △H1=a kJ·mol-1
⑵ 2 H2(g)+ O2(g) = 2 H2O(g) △H2=b kJ·mol-1
⑶ H2(g)+1/2 O2(g) = H2O(l) △H1=c kJ·mol-1
⑷ 2 H2(g)+ O2(g) = 2 H2O(l) △H2=d kJ·mol-1
下列关系式中正确的是 ( )
A.a<b<0 B.b>d>0 C.2a=b<0 D.2c=d>0
23、(16分)某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
|
实验步骤 |
实验现象 |
|
①将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 |
A. 有气体产生,溶液变成浅红色 |
|
②向新制得的Na2S溶液中滴加新制的氯水 |
B. 生成淡黄色沉淀 |
|
③将一小块金属钠放入滴有酚酞溶液的冷水中 |
C. 浮在水面上,熔成小球,做不定向移动,随之消失,溶液变成红色 |
|
④将镁条投入稀盐酸中 |
D. 剧烈反应,迅速产生大量无色气体 |
|
⑤将铝条投入稀盐酸中 |
E. 反应不十分剧烈,产生无色气体 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:认识同周期元素性质的递变规律
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液等。
仪器:试管,滴管,酒精灯,试管夹,镊子,小刀,玻璃片,砂纸等。
(3)实验内容:(填写与实验步骤对应的实验现象的标号和化学方程式)
|
实验内容 |
化学方程式 |
|
① |
|
|
② |
|
|
③ |
|
|
④ |
|
|
⑤ |
|
(4)实验结论:
。
(5)请用原子结构的知识简单解释上述结论:
。
22、PtCl2(NH3)2成平面正方形结构,它可以形成二种固体,一种为淡黄色,在水中溶解度小,另一种为黄绿色,在水中溶解度较大,请在以下空格内画出这两种固体分子的几何构型图。黄绿色固体在水中溶解度比淡黄色固体大,原因是什么?
21、下列物质结构图中,●代表原子序数从1到10的元素 的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表形成共价键的最外层电子,短线代表价键,如,F2: 。以下四种图式各代表的分子是:
。以下四种图式各代表的分子是:
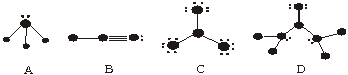
A ,B ,C ,D 。
20、在水溶液中,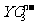 和S2-发生反应的离子方程式如下:
和S2-发生反应的离子方程式如下:
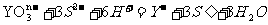 试回答下列问题:
试回答下列问题:
(1)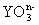 中Y元素的化合价为
,n值是 ;
中Y元素的化合价为
,n值是 ;
(2)Y元素原子的最外层电子数是 ;
(3)比较S2-与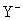 的还原性
。
的还原性
。
19、在HF、H2O、NH3、CH4、N2、CO2、HI分子中:
(1)以非极性键结合的非极性分子是 。
(2)以极性键相结合,具有正四面体结构的非极性分子是 。
(3)以极性键相结合,具有三角锥型结构的极性分子是 。
(4)以极性键相结合,具有折线型结构的极性分子是 。
(5)以极性键相结合,而且分子极性最大的是 。
18、下列各组酸中,酸性依次增强的是( )
A、H2CO3 、H2SiO3 、 H3PO4 B、HNO3 、 H3PO4 、H2SO4
C、 HI、 HCl、 H2S D 、HClO 、 HClO3 、 HClO4
第Ⅱ卷(非选择题,共46分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com