
24.(7分) 将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:
2SO2 +O2
 2SO3 测得平衡时混合物总的物质的量为5mol,求:
2SO3 测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率。
23. (5分)已知100g CaCO3(s)分解生成CaO(s)和CO2(g)需要吸收178kJ热量,12gC(s)燃烧生成CO2(g)放出393.5kJ热量,如果把0.5t CaCO3煅烧成CaO(S),在理论上要用C(s)燃料多少kg?
22、在一个固定体积的密闭容器中,保持一定温度,进行以下反应:
H2(g)+Br2(g) 2HBr(g),已知加入1molH2和2molBr2时,达到平衡后生成amolHBr
2HBr(g),已知加入1molH2和2molBr2时,达到平衡后生成amolHBr
(见下表“已知项”)。在相同条件下,且保持平衡时各组分的百分含量不变,对下列编号(1)-(3)的状态,填写表中空白:
|
编号 |
起始状态(mol) |
平衡时HBr的 物质的量(mol) |
||
|
H2 |
Br2 |
HBr |
||
|
已知 |
1 |
2 |
0 |
a |
|
(1) |
2 |
4 |
0 |
|
|
(2) |
|
|
1 |
0.5a |
|
(3) |
m |
n(n≥2m) |
|
|
21.G.H.盖斯,根据一系列事实于1840年提出“不管化学过程是一步或分数步完成,这一过程热效应相同”。换言之,若一个反应可分成几步反应完成,则各步反应的反应热总和与该反应一次发生时反应热相同。应用这个原理,解决下列问题:
已知:C(s)+O2(g) = CO2(g) ∆H= -393.5kJ/mol
CO(g)+1/2 O2(g) = CO2 (g) ∆H= -283kJ/mol
写出C(s)与O2(g)反应生成CO(g)的热化学方程式:________________________________。
20.已知反应:aA(g) + bB(g)  cC(g)
cC(g)
根据图形推测:
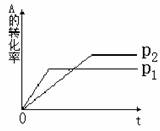
(1)P1 _____P2 ( 填 > 或 < )
(2)a + b _______c ( 填 > 或 < )
19.已知在101 kPa时,CO的燃烧热为283 kJ/mol。在相同条件下,若2 molCH4完全燃烧生成
液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30 倍,则CH4完全燃烧的热化学方程式是: 。
18. (1)250C、101kPa时,___________纯物质完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热,单位是 。
17.当一个可逆反应达到平衡状态后,如果改变____________、___________、________等反应的条件,原来的_______________________会被破坏,化学平衡会发生移动, 建立新的化学平衡。
16.键能的大小可用于估算化学反应的反应热,已知下表数据
|
化学键 |
N = N |
H-H |
N-H |
|
键能/kJ·mol-1 |
946 |
436 |
391 |
工业上制取盐酸可通过下列反应: N2(g)+3H2(g)=2NH3 (g),该反应的反应热DH=____________。
15. 体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
A、等于p% B、大于p% C、小于p% D、无法判断
第Ⅱ卷(非选择题 共55分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com