
27.(14分)已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为气体单质,D为无色气体,在空气中会出现红棕色。各物质的转化关系如下图(部分反应产物已略去)。
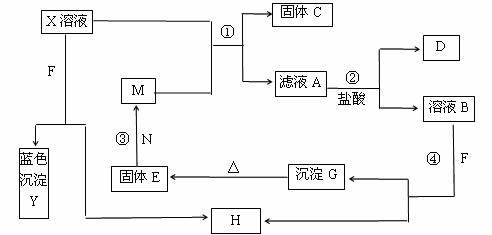
请回答下列问题:
(1)X的化学式为 。
(2)N在氧气中燃烧的实验现象是 。
(3)在反应①②③④中属于置换反应的是 (填序号)。
(4)反应②的离子方程式为_______________________________________________。
(5)X溶液与F反应的总化学方程式为 。
(6)若向100 mL 盐X的溶液中加入10 g金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体C。则滤液A中溶质的物质的量浓度为_____________________。(假设溶液体积不变)
26.(14分)现有X、Y、Z、A、B、C、D几种元素:
①X、Y、Z是原子核外有3层电子的金属元素,原子半径X<Y<Z。
②A、B是非金属元素,它们可与氢化合形成气态氢化物H2A和HB。室温时,A的单质为淡黄色固体,B的单质为液态。
③C是元素周期表中氧化性最强的元素。
④D的单质是常温下呈液态的金属。利用上述已知条件请回答下列问题:
(1)Y在周期表中的位置是 ;H2A的名称为 ;
(2)B 单质的颜色为 。
(3)用电子式表示化合物YB2的形成过程
。
(4)C单质与水反应的化学方程式为
。
(5)X单质与氢氧化钠溶液反应的离子方程式为
。
(6)D单质的蒸气扩散到空气中会对人体产生危害,通常在洒落的D单质上覆盖硫磺进行处理,写出反应的化学方程式 。
13.某密闭容器中进行如下反应:2X(g)+Y(g)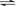 2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足 ( )
2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足 ( )
A.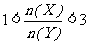 B.
B.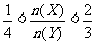
C.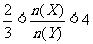 D.
D.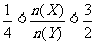
第Ⅱ卷(非选择题,共174分)
12.有A、B、C、D、E、F六瓶不同物质的溶液,它们各是NH3·H2O、Na2CO3、MgSO4、NaHCO3、HNO3和BaCl2溶液中的一种。为了鉴别它们,各取少量溶液进行两两混合,实验结果如右表所示。表中“↓”表示生成沉淀,“↑”表示生成气体,“-”表示观察不到明显现象,空格表示实验未做。试推断其中A是 ( )
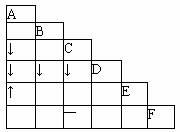
A.Na2CO3溶液
B.BaCl2溶液
C.MgSO4溶液
D.NaHCO3溶液
11.用铝粉和四氧化三铁粉末配成的铝热剂,分成两等份:一份在高温下恰好反应,再与足量稀硫酸反应,生成氢气a L;另一份直接放入足量的氢氧化钠溶液中充分反应,在同条件下生成氢气b L,则a:b为 ( )
A.1:1 B.3:4 C.4:3 D.8:9
10.已知某溶液中存OH-、H+、NH4+和C1-四种离子,其浓度大小有如下关系:
①c(C1-)>c(NH4+)>c(H+)>c(OH-)
②c(C1-)>c(H+)>c(NH4+)>c(OH-)
③c(C1-)=c(NH4+)且c(OH-)=c(H+)
④c(OH-)>c(H+)>c(C1-)>c(NH4+)
|
其中可能的是 ( )
A.①④ B.③⑤ C.①②③ D.④⑤
9.下图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是 ( )
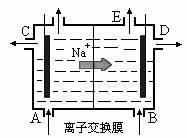
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 LCl2,便产生2 mol NaOH
D.电解一段时间后加适量盐酸可以恢复到电解前的浓度
8.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍。有关下列叙述正确的是( )
A.X肯定为碱金属元素
B.Y、Z两元素形成的化合物熔点较高
C.X、Y两元素形成的化合物可能为离子晶体
D.稳定性:Y的氢化物>Z的氢化物
7.共价键、离子键和分子间作用力都是微粒间的不同相互作用,含有上述中两种相互作用的晶体是 ( )
A.SiO2晶体 B.CCl4晶体 C.NaCl晶体 D.He晶体
6.下列说法摘自一些科普杂志或广告用语,你认为有科学性错误的是 ( )
A.糖类、油脂和蛋白质都是天然的有机化合物
B.医学上可用CuSO4溶液和NaOH溶液检验糖尿病人尿液中的葡萄糖
C.“白雪牌”漂白粉,可令所有化学物质黯然失色,没有最白,只有更白
D.甲醛是某些劣质装饰板材料释放的常见污染物之一
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com