
13.如下图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得两个装置中均通过0.02mol电子时(不考虑盐的水解和溶液体积的变化)则下列叙述中正确的是

A.电极上析出物质的质量:①=②
B.溶液的pH变化:①增大,②不变
C.电极反应式:①中阳极
2Cl--2e- Cl2 ↑
②中负极
2H++2e-
H2↑
D.产生气体的体积:①=②
第Ⅱ卷 非选择题(共174分)
|
|
元素代号 |
U |
V |
W |
X |
Y |
Z |
|
原子半径/nm |
0.037 |
0.157 |
0.066 |
0.070 |
0.077 |
0.143 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2,+4 |
+3 |
请回答:
(1)Y在元素周期表中的位置是 ,镁条在盛有YW2气体的集气瓶中燃烧的现象为 。
(2)V、W、Z三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺序是
(用元素符号表示)。
并用离子方程式表示出Z离子可作净水剂的原因
(3)W、X、Y分别与U可形成10电子共价化合物,三者均可形成 晶体,其中沸点最高的是(写化学式)__ ;1g YU4气体完全燃烧生成液态水时,放出a kJ的热量,则该反应的热化学方程式为 。
(4)现有Z与V2W2的固体混合物样品,加入稀盐酸至混合物完全溶解,所得的混合液中c(Z3+)︰c(H+)︰c(Cl-)=1︰2︰8,则原固体混合物中,Z元素与W元素的质量比为
(最简整数比)。
12.没食子儿茶素的结构简式如下所示,它是目前尚不能人工合成的纯天然的抗氧化剂。下列有关该物质的叙述正确的是
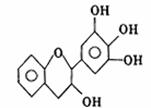
|
B.1mol该物质与4molNaOH恰好完全反应
C.该物质在浓硫酸作用下可发生消去反应
D.该物质可以和溴水发生取代反应和加成反应
11.将 4 mol A 气体和 2 mol B 气体在 2 L 的密闭容器中混合并在一定条件下发生如下反应 2A(g)+B(g) 2C(g);△H <0 。 4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1 ,下列说法中正确的是
2C(g);△H <0 。 4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1 ,下列说法中正确的是
A.当A 、B、C的物质的量浓度之比为 2:1:2时,反应即达到平衡状态
B.4 s 内用物质B表示的反应速率为0.075 mol·L-1·S-1
C.达平衡后若通入一定量氦气,A的转化率降低
D.达平衡后若升高温度,C的浓度将增大
10.下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Na+、Cu2+、OH-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中: Na+、NH4+、SCN-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
A.①② B.③⑥ C.②④ D.③⑤
9.下列操作中,能使电离平衡H2O H++OH–,向右移动且溶液呈酸性的是
H++OH–,向右移动且溶液呈酸性的是
A.向水中加入NaHSO4溶液 B.向水中加入Al2(SO4)3溶液
C.向水中加入Na2CO3溶液 D.将水加热到100°C,使pH=6
8.下列说法正确的是
A.1 L 0.5mol·L-1CaC12溶液中含有氯离子数约为6.02×1023
B.30gC2H6中含有共价键数约为6×6.02×1023
C.18gD2O中含有电子数约为10×6.02×1023
D.标准状况下1mol苯所占的体积约为22.4L
7. 表示下列变化的化学用语正确的是
表示下列变化的化学用语正确的是
A.NaHCO3的水解 HCO3-+H2 O H3O++CO32-
B.金属铝溶于NaOH溶液 Al+2OH- =A1O2-+H2↑
C.钢铁吸氧腐蚀的正极反应 4OH- -4e-=O2↑+2H2O
D.1 L0. 5 mol·L-1稀硫酸与1 L 1 mol·L-1氢氧化钠溶液反应放出57. 3kJ的热量
H2SO4(aq)+2NaOH(aq) = Na2SO4(aq)+2H2O(1);△H=-114.6 kJ/mol
6.充分利用能源、提高原子利用率、减少向环境排放废弃物等都是“绿色化学”的基本要求。① 实验室短时间保存硫酸亚铁溶液时,向试剂瓶中添加少量铁粉和稀硫酸; ② 用稀硝酸代替浓硝酸溶解、回收做银镜实验后试管内壁的银; ③接触法制硫酸的设备中安装“热交换器”,利用余热预热冷原料气; ④工业合成氨中分离产物得到氢气和氮气再循环使用。上述主要从“绿色化学”角度考虑的是
A.①② B.②④ C.②③④ D.①③④
29.(16分)下图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去)。请根据下列要求回答问题。

(1)若烧瓶中盛装锌片,分液漏斗中盛装稀硫酸,则:
① 当仪器连接顺序为A→C→B→B→D时,两次使用B装置,其中所盛的药品依次是CuO、无水CuSO4粉末。此实验的目的是 。D装置的作用是 。
② 为了使B中CuO反应充分,在不改变现有药品的条件下,可采取的方法有(写一种) 。
③加热前必须进行的操作是 。
(2)若烧瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞,则:
①烧瓶内产生的气体主要有(写化学式) 。
②用产生的气体做氨的催化氧化实验,各仪器装置按气流方向从左到右连接顺序是(填字母)( )→( )→( )→( );装置B中可能观察到的现象是 。
28.(16分)A、B、C、D四种芳香族化合物的结构简式如下所示:

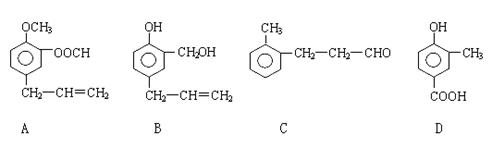
请回答下列问题:
(1)写出A中无氧官能团的名称 ,C中含氧官能团的结构简式为 。
(2)用A、B、C、D填空:能发生银镜反应的有 ,既能与FeCl3溶液发生显色反应又能与Na2CO3溶液反应放出气体的是 。
(3)按下图C经一步反应可生成E,E是B的同分异构体,
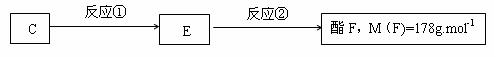
则反应①的反应类型为 ,写出反应②的化学方程式: 。
(4)G、H和D互为同分异构体,它们具有如下特点:
① G和H都是苯二元取代物,这两个取代基分别为羟基和含有-COO-结构的基团;
② G和H苯环上的一氯代物有两种不同结构;
③ G可以发生银镜反应,H分子中苯环不与取代基碳原子直接相连 。
写出G和H的结构简式:G: ;H: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com