
7.阿伏加德罗常数约为6.02×1023mol-1,下列有关叙述正确的是 ( )
A.2.24 LCO2中含有的原子数为0.3× 6.02×1023
D.500 mL0.2mol/L的Fe2 (SO4)3溶液中Fe3+总数为0.2×6.02×1023
C.5.6 g铁粉与硝酸完全反应失去的电子数一定为0.3×6.02×1023
D.5.8 g正丁烷和异丁烷的混合气体中含有共价键的总数为1.3×6.02×1023
6.2008年奥运会即将在北京举行,下列有关说法不正确的是 ( )
A.北京奥运省祥物”福娃”的材质是PVC(聚氯乙烯),其单体的结构是CH2=CHCl
B.北京奥运火炬“祥云”的燃料为丙烷,其分子式为C3H8
C.北京奥运奖牌“金镶玉”中玉的化学成分多为含水钙镁硅酸盐,如:
Ca2Mg5Si8O22(OH) 2可用氧化物表示为2CaO·5MgO·8SiO2·H2O
D.北京奥运村、媒体村等多处使用高能锂电池,和其它原电池相比,其最显著的特点是提供相同的电量所消耗的金属正极质量最小
29.(17 分)已知只含C、H、O元素的有机物R和M的相对分子质量均为90。回答下列问题:
Ⅰ(1)若1molR号足量NaHCO3溶液或足量Na反应均产生1mol气体,则R的化学式为 。
(2)若R在浓硫酸作用下脱水可形成六元环状化合物,则R与足量Na反应的化学方程式为 。
(3)用R聚合的纤维非常适用于做手术缝合线,尤其是人体内部器官的手术,该聚合纤维在人体内的降解过程分为2步:首先降解为单体,第二步降解为CO2和H2O,试写出第一步降解的化学方程式: 。(不写反应条件)
(4)R可以与精制铁粉反应制备一种药物,同时生成H2,该药物可以治疗的疾病是
。
Ⅱ若1molM与足量NaHCO3溶液反应产生2mol气体,则M的俗称为 ;M受热分解可以得到三种氧化物,该反应方程式为 。
M的溶液经常用做测定高锰酸钾溶液的浓度,这是利用M的 (填“氧化性”、“还原性”、“酸性”或“碱性”)
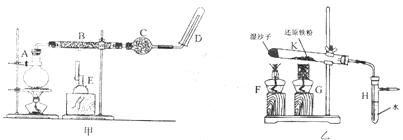
28.(13分)某同学欲在实验室中完成Fe与水蒸气反应的实验,实验装置如图,其中甲为课本中演示实验的装置,乙为该同学采用的改进后的实验装置。已知B中放入的是铁与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒精灯。对比两装置,回答下列问题:
(1)如何检查乙装置的气密性? 。
(2)乙装置中湿沙子的作用是 。
(3)G处铁丝网罩的作用是 ,乙装置K中发生反应的化学方程式是
。
(4)该同学认为欲在乙装置的尖嘴导管处点燃反应产生的气体,装置H必不可少,H的作用是 。
(5)对比甲、乙两装置的B和K,B的优点是 。
27.(17分)有A、B、C、D、E五种元素,原子序数依次增大,分别位于不同的三个短周期,其中,B与D可形成DB2、DB3两种化合物,在同周期元素中,C的金属性最强,F的非金属性最强。试回答下列问题:
(1)A、B形成的化合物与DB3反应生成一种强酸的化学方程式为 。
(2)已知DB2在一定条件下可转化为DB3,工业上一进行这一反应的设备是 .
工业上完成这一转化的适宜条件为 。
(3)由C与B形成的原子个数比为1∶1的离子化合物与CO2反应的化学方程式为 ,此反应的用途是 。
(4)由D形成的单质为 晶体(填“离子”、“分子”或“原子”)。
(5)用铂作电极电解由C、E形成的化合物的饱和溶液500 mL一段时间后,当溶液的pH=12时,阳极产物的化学式为 ,体积为 L。(标准状况,电解前后溶液体积的变化忽略不计,假设气体完全逸出)。
26.(13分)已知A、B、C是三种单质,甲、乙是化合物,其全部物质的转化关系如图所示(图中反应条件均已略去),请回答下列问题:
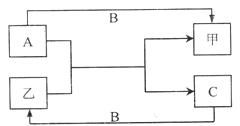
(1)通常状况下,B、C为常见的气体单质,乙是液态化合物。
若A为气体单质,A、C两种元素属于第二周期相邻元素,写出A与乙反成生成甲和C的化学方程式 。
若A是固体,甲、C均为可燃性气体,1g固体A和乙的蒸汽在高温条件下发生反应生成甲和C,吸收热量11kJ,写出该反应的热化学方程式 。
(2)通常状况下,若A、B、乙均为气体,A与乙在一定条件下反应生成黄色固体C,写出甲的电子式 。
(3)若A、B、C都是短周期非金属元素单质,A、C所含元素同主族,A、B所含元素同周期,写出乙与Na2CO3在一定条件下反应的化学方程式 .
13.为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,该生物芯片可快捷检测常见的16种兴奋剂。已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示。下列叙述中正确的是( )
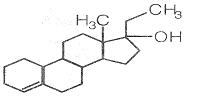
A.该物质可视为酚类
B.在浓硫酸作用下,分子内消去一个水分子,产物有两种结构
C.该物质不能发生还原反应 D.该物质分子中的所有碳原子均共面
第Ⅱ卷
|
非选择题:共10小题,共174分。
12. 在一密闭容器中发生化学反应:2A(g) B(g)+C(g);在几种不同条件下进行,其中B、C的起始物质的量为0,反应物A的物质的量随时间变化如图所示,下列说法一定正确的是 ( )
在一密闭容器中发生化学反应:2A(g) B(g)+C(g);在几种不同条件下进行,其中B、C的起始物质的量为0,反应物A的物质的量随时间变化如图所示,下列说法一定正确的是 ( )
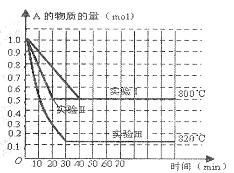
A.实验Ⅱ和实验Ⅰ比较,实验Ⅱ一定使用了催化剂
B.在实验Ⅰ中,若容器的体积为1L,则从开始到达到平衡时间内A的增
均反应速率为0.01mol(L·min)
C.在800℃时,增在压强,若反应重新达平衡时混合气体对氢气的相对密度为64.5,则A的相对分子质量为64.5
D.该反应正反应为吸热反应
11.在一定温度下,某浓度的硝酸与金属锌反应生成NO2和NO,两者的物质的量之比为1:3,则要使1mol金属锌完全反应,需要硝酸的物质的量为 ( )
A.2.8mol B.2.6mol C.2.4mol D.0.8mol
9.下列化学用语表述正确的是 ( )
A.钢铁腐蚀时可能发生的正极反应:4OH--
4e-=O2 +2H2O
+2H2O
B.小苏打水解反应的离子方程式:HCO3- + H2O 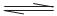 CO32-+H3O+
CO32-+H3O+
C.电解精炼铜的阴极反应式:Cu-2e-=Cu2+
D.向NaAlO2溶液中通足量CO2的离子方程式:AlO2-+CO2+2H2O=Al(OH)3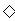 +
+
HCO3-
|
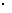 10-24,该无色溶液中可能大量共存的离子组是 ( )
10-24,该无色溶液中可能大量共存的离子组是 ( )
A.AlO2-、K+、NH4+、Na+ B.K+、S2-、SO32-、Na+
C.Na+、Br-、Fe2+、Cl- D.S2-、K+、Cl-、HCO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com