
27.(15分)
为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将a g铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580mL(标准状况);方案二:将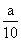 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00mL KMnO4溶液。
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00mL KMnO4溶液。
请回答下列问题:
(1)配平下面的化学方程式(将有关的化学计量数填入答题卡的横线上):
□KMnO4+□FeSO4+□H2SO4=□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
(2)在滴定实验中不能选择 式滴定管,理由是 ;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为 和
;(铁的相对原子质量以55.9计)
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一 (填“准确”“不准确”“不一定准确”),理由是 ;
②方案二 (填“准确”“不准确”“不一定准确”),理由是 。
26.(14分)
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。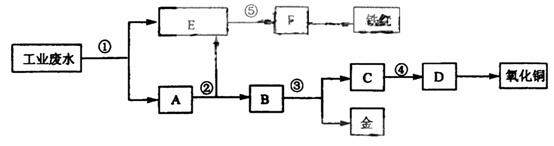
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ ;
(2)写出①处发生反应的离子方程式 ;写出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
25.(14分)
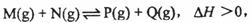 已知可逆反应:
已知可逆反应:
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol,L-1, c(N)=2.4 mol·L-1; 达到平衡后,M的转化率为60%,此时N的转化率为 ;
(2)若反应温度升高,M的转化率 (填“增大”“减小”或“不变”;)
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 1 mol·L-1,
c(N)= a mol·L-1;达到平衡后,c(p)=2 mol·L-1, a= ;
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol,L-1,达到平衡后,M的转化率为 。
28.(14分)由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):
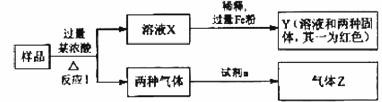
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显、变化,说明样品中不含有的物质是(填写化学式)______________。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是_______________________________________________________。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是_________________。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)___________________________。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈落色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是_________________________。
(5)另取原样品,加入足量稀硫酸充分反应。若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中的物质用化学式表示)____________________________________。
27.(17分)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
已知:X+Y Z+W
Z+W
(1)Y的电子式是_________________________。
(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是_________________________________。
(3)用图示装置制备NO并验证其还原性。有下列主要操作:
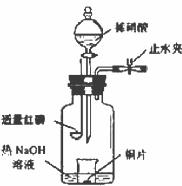
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是_______________________________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是______________________。
③步骤c滴入稀硝酸后烧杯中的现象是______________________________________
______________________________________________________________________。
反应的离子方程式是____________________________________________________。
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
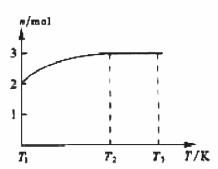
①温度在T1-T2之间,反应的化学方程式是_________________________。
②温度在T2-T3之间,气体的平均相对分子质量是(保留1位小数)______________。
26.(3分)通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+ I2+Z+H2O常作为Y的临定反应。
(1)Y与Z的关系是(选填字母)_______。
a.同位素 b.同系物 c.同素异形体 d.同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法_________________________________________________________________
________________________________________________________________________。
(3)举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示)。
________________________________________________________________________。
(4)气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种酸)。
①HCN分子中含有4个共价键,其结构式是___________________________________。 ②KCN溶液显碱性,原因是(用离子方程式表示)_____________________________。
(5)加热条件下,足量的Z与某金属M的盐MCR3(C为碳原素)完全反应生成CR2和MmRn(m、n均为正整数)。若CR2质量为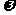 1g,MmRn质量为
1g,MmRn质量为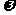 2g,M的相对原子质量为a,则MmRn中m:n=_____________(用含
2g,M的相对原子质量为a,则MmRn中m:n=_____________(用含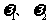 和a的代数式表示)。
和a的代数式表示)。
12.工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)=Si(s)+4HCl(g);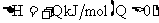
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
第Ⅱ卷(非选择 )
25(16分)菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸
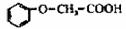 发生化反应的产物。
发生化反应的产物。
(1)甲一定含有的官能团的名称是____________________________________。
(2)5.8 g甲完全燃烧可产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是_____________________________。
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl2溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写出任意2种的结构简式)
_____________________________________________________。
(4)已知:
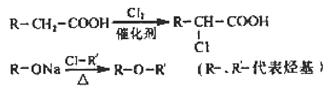
菠萝酯的合成路线如下:

①试剂X不可选用的是(选填字母)____________。
a.CH3COONa溶液 b. NaOH溶液 c.NaHCO3溶液 d. Na
②丙的结构简式是_________________,反应Ⅱ的反应类型是___________。
③反应Ⅳ的化学方程式是
_______________________________________________________________________。
11.下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液Ph=7时,c (SO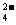 )>c (NH
)>c (NH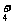 )
)
B.两种蜡酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中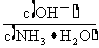 增大
增大
10.X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是
A.由mXa+与nYb-,得m+a=n-b
B.X2-的还原性一定大于Y-
C. X, Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
9.下列各组物质的无色溶液,不用其它试剂即可鉴别的是
①KOH Na2SO4 AlCl3 ②NaHCO3 Ba(OH)2 H2SO4
③HCl NaAlO2 ④Ca(OH)2 Na2CO3 BaCl3
A.①② B.②③ C.①③④ D.①②④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com