
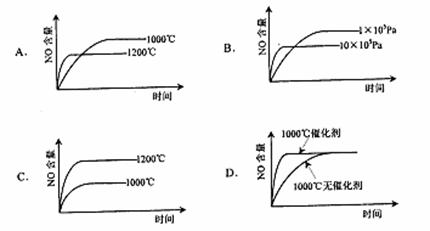
11.已知:4NH3(g)+5O2(g)==4NO(g)+6H2O(g),△H=-1025kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
10.下列叙述中正确的是
A.NH3、CO、CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.HF、HCI、HBr、HI的稳定性依次增强
D.CS2、H2O、C2H2都是直线型分子
9.下列各组给定原子序数的元素,不能形成原子数之比为1:l稳定化合物的是
A.3和17 B.1和8 C.1和6 D.7和12
8. 下列各组物质不属于同分异构体的是
A.2,2-二甲基丙醇和2-甲基丁醇 B.邻氯甲苯和对氯甲苯
C.2-甲基丁烷和戊烷 D.甲基丙烯酸和甲酸丙酯
7.下列化合物,按其晶体的熔点由高到低排列正确的是
A.SiO2 CsCl CBr4 CF4 B.SiO2 CsCl CF4 CBr4
C.CsCl SiO2 CBr4 CF4 D.CF4 CBr4 CsCl SiO2
6.在溶液中加入足量Na2O2后仍能大量共存的离子组是
A.NH4+、Ba2+、Cl-、NO3‑ B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32-
29、(17分)
A、B、C、D、E、F、G、H、I、J均为有机化合物。根据以下框图,回答问题:
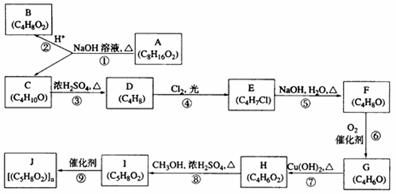
(1)B和C均为有支链的有机化合物,B的结构简式为___________;C在浓硫酸作用下加热反应只能生成一种烯烃D,D的结构简式为:________________________________;
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为_____________;
(3)⑤的化学方程式是_____________________________________________;
⑨的化学方程式是_____________________________________________;
(4)①的反应类型是_________________,④的反应类型是_________________,⑦的反应类型是_________________;
(6) 与H具有相同官能团的H的同分异构体的结构简式为
___________________________________________________;
28、(13分)
某钠盐溶液可能含有阴离子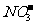 CO32-,,SO32-,
SO42- Cl- ,Br- ,I-。为鉴定这些离子,分别取少量溶液进行以下实验:
CO32-,,SO32-,
SO42- Cl- ,Br- ,I-。为鉴定这些离子,分别取少量溶液进行以下实验:
① 测得混合液呈碱性;
② 加HCl后,生成无色无味气体。该气体能使饱和石灰水溶液变浑浊;
③ 加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
④ 加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤ 加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一实验鉴定离子的结论与理由。
实验①__________________________________________________________;
实验②__________________________________________________________;
实验③__________________________________________________________;
实验④__________________________________________________________;
实验⑤__________________________________________________________;
(2)上述5个实验不能确定是否存在的离子是_______________________。
26、(15分)
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
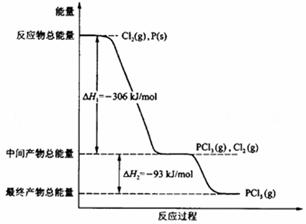
根据上图回答下列问题:
(1) P和Cl2反应生成PCl3的热化学方程式是
______________________________________________________________________;
(2) PCl5分解成PCl3和Cl2的热化学方程式是
______________________________________________________________________;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于______;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2______α1(填“大于”、“小于”或“等于”);
(3) 工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是____________________________________________;
(4) P和Cl2分两步反应生成1mol PCl5的△H3=__________(填“大于”、“小于”或“等于”)。
(5) PCl5与足量水充分反应,最终生成两种酸,其化学方程式是 __________________;
27(15分)
Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z。
(1)Q 的最高价氧化物,其固态属于____________晶体,俗名叫_____________;
(2)R的氢化物分子的空间构型是___________,属于___________分子(填“极性”或“非极性”);它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是___________;
(3)X的常见氢化物的空间构型是___________;它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是___________;
(4)Q分别与Y、Z形成的共价化合物的化学式是___________和____________;Q与Y形成的分子的电子式是____________,属于__________分子(填“极性”或(“非极性”)
13、在相同温度和压强下,对反应CO2(g)+H2(g) 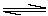 CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
 |
CO2 |
H2 |
CO |
H2O |
|
甲 |
a mol |
a mol |
0 mol |
0 mol |
|
乙 |
2a mol |
a mol |
0 mol |
0 mol |
|
丙 |
0mol |
0 mol |
a mol |
a mol |
|
丁 |
a mol |
0 mol |
a mol |
a mol |
上述四种情况达到平衡后,n(CO)的大小顺序是
A、乙=丁>丙=甲 B、乙>丁>甲>丙
C、丁>乙>丙=甲 D、丁>丙>乙>甲
第Ⅱ卷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com