
9.常温下,下列溶液中可能大量共存的离子组是 ( )
A.含有大量S2-的溶液:Na+、ClO―、Cl―、CO32―
B.含有大量Fe3+的溶液:K+、Na+、AlO2―、SO42―
C.能使pH试纸变红的溶液:NH4+、Na+、NO3―、HCO3―
D.水电离产生的c(H+)=1×10-12mol·L―1的溶液:Mg2+、SO42―、NO3―、Cl―
|
A.鉴别氯化铝和氯化镁溶液:分别滴加过量的氢氧化钠溶液
B.除去氯化铵溶液中的氯化铁:向溶液中滴加适量氢氧化钠溶液,过滤
C.除去苯中的苯酚:向溶液中加入浓溴水,过滤
D.检验溴乙烷中的溴元素:在溴乙烷中滴入氢氧化钾溶液加热后,用稀硝酸酸化再滴加硝酸银溶液
8.下列六种工业生产:①用海水为原料提取镁 ②制硅酸盐水泥 ③制普通玻璃 ④冶炼生铁 ⑤制漂白粉 ⑥接触法制硫酸,其中必需用到石灰石作为原料的是 ( )
A.①②③④⑤ B.②③④⑤⑥
C.①②③⑤⑥ D.①②③④⑤⑥
7. 下表是元素周期表的一部分。X、Y、Z、W均为短周期元素,Z元素原子最外层电子数与电子总数之比为3∶8。下列说法错误的是( )
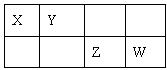
A.Z的气态氢化物的稳定性最差
B.原子半径由大到小的顺序为:Z>W>X>Y
C.X元素只能形成一种单质
D.Y元素可形成多种氧化物
6.阿伏加德罗常数约为6.02×1023mol―1,下列说法中一定正确的是 ( )
A.1L 1mol·L―1的HAc溶液中含有6.02×1023个氢离子
B.18g D2O(重水)完全电解,转移6.02×1023个电子
C.22.4L SO2气体,所含氧原子数为2×6.02×1023
D.14g乙烯和丙烯的混合物中,含有共用电子对数目为3×6.02×1023
5.下列离子方程式错误的是 ( )
A.氯气通入水中:C12 + H2O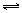 H+ + C1- + HClO
H+ + C1- + HClO
B.向3%的双氧水中通入少量SO2:H2O2 + SO2 = 2H+ + SO42―
C.碳酸钠水解:CO32― + 2H2O = H2CO3 + 2OH-
D.向NaHCO3溶液中加入过量石灰水:Ca2++OH-+ HCO3- = CaCO3↓+H2O
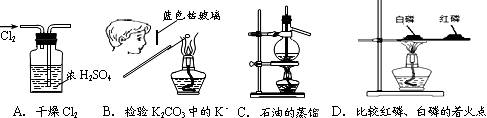
4.用下列实验装置完成对应的实验(部分仪器已省略),操作正确并能达到实验目的的是
( )
3. 氮化硅(Si3N4)是一种具有耐高温等优异性能的新型陶瓷。工业上可用下列方法制取:3SiO2+6C+2N2 高温 Si3N4+6CO。下列说法正确的是 ( )
A.氮化硅晶体属于分子晶体
B.氮化硅中氮元素的化合价为―3
C.上述反应中,N2是还原剂,SiO2是氧化剂
D.上述反应中,每生成1mol Si3N4,N2得到6mol电子
2.下列各项表达中正确的是 ( )
A.NaCl的电子式: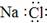 B.钾原子结构示意图:
B.钾原子结构示意图: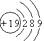
C.光气COCl2的结构式: D.聚丙烯的结构简式:
D.聚丙烯的结构简式: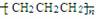
1. 空气中的自由电子附着在气体分子或原子上形成的空气负离子(也叫阴离子)被人们称为“空气维生素”。下列各微粒中不属于空气负离子的是 ( )
A.O2― C.O2―·(H2O)n
C.CO4―·(H2O)n D.PO43―
29.(16分)在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且
1 molXY2含有54 mol电子.
(1)该融雪剂的化学式是 ;X与氢元素形成的化合物的电子式是 .
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是 ;D与E能形成一种非极性分子,该分子的结构式为 ;D所在族元素的氢化物中,沸点最低的是 .
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是 .
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com