
20.某研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,锰化合物的还原产物都是MnCl2(如:K2MnO4+8HCl= MnCl2+2Cl2↑+2KCl+4H2O)。他们又进行了以下一些有关定量的实验,按要求填空或计算(气体体积都折合成标准状况):
(1)称取了31.6gKMnO4粉末,放在试管中加热充分反应后,收集到气体的体积是
;另取31.6gKMnO4粉末和足量盐酸反应,收集到气体体积是 。
(2)将31.6gKMnO4粉末加热一段时间,收集到1.12L气体后停止加热,冷却后放入足量的浓盐酸再加热,又收集到气体体积是 。
(3)将a molKMnO4粉末加热一段时间,收集到V1L气体后停止加热,冷却后放入足量的浓盐酸再加热反应充分后,又收集到气体体积V2L。则V2=
(用a、V1表达)。
19.(12分)某酯A的化学式为C9H10O2,且A分子中只含有1个苯环,苯环上只有一个取代基。现测出A的1H-NMR谱图有5个峰,其面积之比为1︰2︰2︰2︰3。利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如下图:
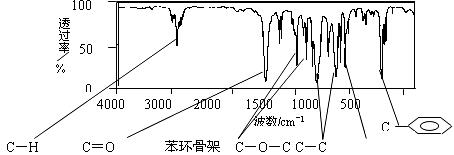
试回答下列问题。
(1)A的结构简式可为C6H5COOCH2CH3 C6H5CH2OOCCCH3、 。
(2)A的芳香类同分异构体有多种,请按要求写出其中不含甲基且属于芳香酸的B的结构简式: 。
(3)已知C是A的同分异构体,分子中不含甲基,且遇FeCl3溶液显紫色,苯环上只有两个对位取代基的芳香醛,且有如下转化关系。
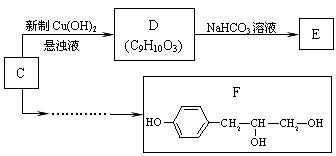
① 写出D  E的化学方程式
。
E的化学方程式
。
② 请用合成反应流程图表示出由C合成F的最合理的合成方案(注明反应条件)。
提示:合成反应流程图表示方法示例如下:
18.(10分)过碳酸钠(2Na2CO3·3H2O2)俗称固体双氧水,是一种很好的消毒剂和供氧剂(有活性氧存在),外观为白色自由流动颗粒,其制备流程如下图所示。图中BC-1、BC-2均为稳定剂,其中BC-1是由异丙醇和三乙醇胺按一定比例混合而成。
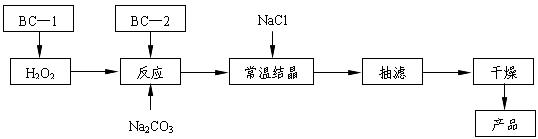
过碳酸钠简易制备工艺路线
(1)制备过程中加入BC-1的目的是 。
(2)结晶过程中加入氯化钠、搅拌,作用是 。
(3)洗涤抽滤产品,合适的洗涤试剂是 (填选项编号)。
A.饱和NaCl溶液 B.水 C.异丙醇 D.碳酸钠饱和溶液
(4)写出制备过碳酸钠的方程式: 。
(5)由实验测定反应温度对产物的影响如下表:
|
T/°C |
活性氧百分含量 |
产率 |
|
5-10 |
13.94 |
85.49 |
|
10-15 |
14.02 |
85.78 |
|
15-20 |
15.05 |
88.38 |
|
20-25 |
14.46 |
83.01 |
根据上表数据,你认为反应最佳的温度选择的范围是 。
17.(10分)如下图所示的物质的相互转变中,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应。常温下,D、E、G均是气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%。
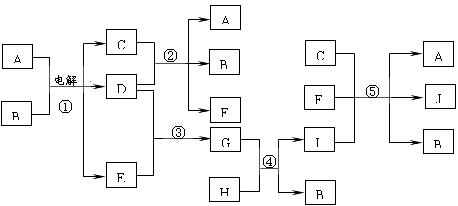
请回答下列问题:
(1)写出F的化学式: ;
(2)写出G的电子式: ;
(3)反应①的化学方程式为 ;
人们将反应①所涉及的化学工业称为 ;
(4)反应⑤的离子方程式为 ;
高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为
①Na2FeO4具有强氧化性可杀菌消毒
② 。
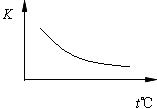
16.(8分)工业上制备H2的一种重要方法是:CO(g)+H2O(g) CO2(g)+H2(g) △H=Q kJ·mol―1。已知该反应的平衡常数K与温度的关系如图所示。若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
CO2(g)+H2(g) △H=Q kJ·mol―1。已知该反应的平衡常数K与温度的关系如图所示。若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
|
时间/min |
CO(g) |
H2O(g) |
CO2(g) |
H2(g) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c4 |
|
4 |
c1 |
c2 |
c3 |
c4 |
已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)下列可以判断该反应达到化学平衡状态的是 。
A.单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中H2(g)的浓度不再发生改变
D.氢气的生成速率等于水的消耗速率
(2)Q 0(填“>”、“=”或“<”=。
(3)若在850℃时向反应容器中充入H2O(g),K值 (填“增大”、“减小”或“不变”,下同);若升高反应体系的温度,K值 。
(4)上表中c2为 mol·L=1,CO(g)的转化率为 。
15.(12分)某校三个研究性学习小组对“葡萄糖溶液与新制的氢氧化铜悬浊液作用得到的砖红色沉淀是Cu2O”提出质疑。
(1)甲小组认为红色沉淀不一定是Cu2O,为此展开了确定红色沉淀成分的研究。
步骤一:提出假设: 。
步骤二:查阅资料。得出:① +1价的铜在酸性条件下易发生自身氧化还原反应;
② 在空气中灼烧氧化亚铜生成氧化铜。
步骤三:设计方案、实验。
A.取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
B.取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
C.取该红色沉淀ag,在空气中充分灼烧至完全变黑,放在干燥器里冷却,再称重,反复多次至固体恒重,称得质量为bg,比较a,b的关系
D.取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色沉淀析出。
你认为合理的方案是(填字母) 。
(2)乙小组针对甲小组的假设,另设计如下图装置进行验证。
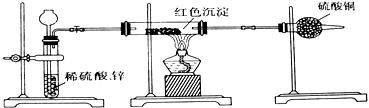
若按乙组装置定性检验上述红色沉淀成分,可根据 现象的发生与否即可判断。
若按乙组装置定量测定上述红色沉淀的成分,你认为理论上应该测定下列哪些物理量 (填序号)。
①通入氢气的体积;
②反应前红色沉淀和硬质玻管的总质量;
③完全反应后红色固体和硬质玻璃管的总质量;
④实验前干燥管质量;
⑤硬质玻璃管质量;
⑥锌粒质量;
⑦稀硫酸中含溶质的量;
⑧实验后干燥管质量
该实验装置中距实际可行性方面存在的缺陷有
(请写出两点)。
14.在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g) xC(g)+D(s),向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是 ( )
xC(g)+D(s),向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是 ( )
A.若平衡时,甲、乙两容器中A的物质的量不相等,则x=4
B.平衡时,甲、乙两容器中A、B的物质的量之比不相等
C.平衡时甲中A的体积分数为40%
D.若平衡时两容器中的压强不相等,则两容器中压强之比为8∶5
第Ⅱ卷(非选择题,共72分)
|
13.甲醇燃料电池(DMFC)可用于笔记本电脑、汽车等,该燃料电池是以甲醇为燃料,氧气为氧化剂,电解质可以是质子交换膜(可传导氢离子),也可以是固体氧化物(可传导氧离子),甲醇和氧气分别在多孔金属电极上发生反应,从而将化学能直接转化为电能。下列叙述中错误的是 ( )
A.电池放电时,甲醇在负极发生氧化反应
B.以固体氧化物为电解质的电池放电时,氧离子由负极移向正极
C.以质子交换膜为电解质的电池放电时,正极的反应为:O2+4H++4e- 2H2O
D.电池的总反应是:2CH3OH+3O2 2CO2+4H2O
12.某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA-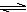 H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液:
① 0.01mol·L―1的H2A溶液
② 0.01mol·L―1的NaHA溶液
③ 0.02mol·L―1的HCl溶液与0.04mol·L―1的NaHA溶液等体积混合
④ 0.02mol·L―1的NaOH溶液与0.02mol·L―1的NaHA溶液等体积混合
下列关于上述四种溶液的说法正确的是 ( )
A.溶液②中存在水解平衡:HA-+H2O 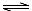 H2A+OH-
H2A+OH-
B.溶液③中有:c(HA-)+2c(A2-)=c(Na+)
C.溶液④中有:c(OH-)=c(H+)+c(HA-)
D.四种溶液中c(HA-)浓度大小:③>①>②>④
11.盐酸乙哌立松片是一种骨骼肌松弛剂,能改善由肩周炎、腰痛症等引起的肌紧张状况。其有效成分的结构简式如下: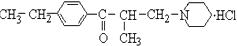
下列关于该化合物的说法错误的是 ( )
A.它是芳香族化合物
B.它易溶于水,较易溶于乙醇,却难溶于丙酮
C.它能发生还原反应
D.它不能使酸性高锰酸钾溶液褪色
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com