
27.(14 分)水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g) CO (g) +H2 (g);△H =+131.3kJ•mol-1
CO (g) +H2 (g);△H =+131.3kJ•mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。
|
容器 编号 |
c(H2O)/mol·L-1 |
c(CO)/mol·L-1 |
c(H2)/mol·L-1 |
V正、V逆比较 |
|
I |
0.06 |
0.60 |
0.10 |
V正=V逆 |
|
II |
0.06 |
0.50 |
0.40 |
②? |
|
III |
0.12 |
0.40 |
0.80 |
V正<V逆 |
|
IV |
0.12 |
0.30 |
①? |
V正=V逆 |
请根据上表数据计算出该温度下该反应的平衡常数的数值 (3分)
填写表中相应的空格① (2分)、② (2分);
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和 1.0mol水蒸气,发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍,平衡时水蒸气的转化率为 (2分);向该容器中补充 a mol 炭,水蒸气的转化率将 (填 “增大”、“减小”、“不变”)(2分)。
(3)己知:CO(g) + 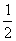 O2(g) =CO2 (g);△H =-283.0 kJ·mo1-1
O2(g) =CO2 (g);△H =-283.0 kJ·mo1-1
H2(g) + 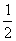 O2 (g) =H2O (g);△H = -241.8kJ·mo1-1
O2 (g) =H2O (g);△H = -241.8kJ·mo1-1
C(s) + 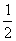 O2(g)=CO (g);△H = -110.5kJ·mo1-1
O2(g)=CO (g);△H = -110.5kJ·mo1-1
那么,将12 g 炭完全转化为水煤气,然后再燃烧,整个过程放出 kJ的热量。(3分)
选考题(每科选做1题,共做3题)
26.(14分) 有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阳离子和一种阴离子且互不重复)
|
阳离子 |
K+、Na+、Ba2+、NH4+ |
|
阴离子 |
CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,B溶液的pH小于7,A、B的溶液中水的电离程度相同;D溶液焰色反应显黄色。
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A的名称是 (3分)
(2)写出C溶液和D溶液反应的化学方程式 (3分)
(3)25℃时pH=9的A 溶液和pH=9的C溶液中水的电离程度小的是 (填的A或C化学式);(2分)
(4)25℃时用惰性电极电解D的水溶液,一段时间后溶液的pH 7;(填>、< 或=)(2分)
(5)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为 ;(2分)
(6)室温时在一定体积0.2mol·L-1的C溶液中,加入一定体积的0.1mol·L-1的盐酸时,混合溶液的pH=13,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是 。(2分)
25.(15分)某校化学实验兴趣小组进行实验室制取纯净的氯气、并验证氯气的某些化学性质实验,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
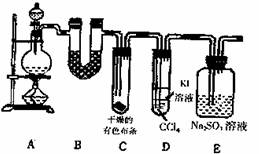
(1)下列方法中,不能用于制氯气的是 (2分)
① MnO2和浓盐酸混合共热; ② NaCl固体和浓硫酸混合共热;
③ 次氯酸钠和稀硫酸混合; ④ KMnO4和浓盐酸混合。
⑤ KClO3和浓盐酸混合;
(2)写出A装置中玻璃仪器的名称 (3分)
(3)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得Cl2的体积(标准状况下)总是小于1.12L的原因是 (2分)
(4)装置C中的现象是 (2分)
装置D振荡后静置,下层溶液的现象是 (2分)
装置E中发生反应的离子方程式为 (2分)
(5)乙同学认为甲同学的实验有缺陷 ,该缺陷可能是
。(2分)
13.向100mL0.25mol/L的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是 ( )
A.3.45g B.2.3g C.1.15g D.0.575g
第Ⅱ卷(必考题129分,选考题45分,共174分)
|
必考题(共8道题)
12. 下列化合物中,不能通过化合反应而得到的是 ( )
①SO3 ②Fe(OH)3 ③H2SiO3 ④NaHCO3 ⑤FeCl2
A.只有③ B.①③ C.①⑤ D.②③
11. 下列溶液一定呈中性的是 ( )
A.氢氧化钠溶液与醋酸溶液混合后c(Na+)= c(CH3COO-)的溶液
B.等物质的量的强酸和强碱反应后所得到的混合溶液
C.室温时将pH=5的盐酸稀释100倍所得到的溶液
D.硝酸铵溶于水得到的溶液
9.下列叙述正确的是 ( )
A. 常温常压下28g CO与22.4L O2所含分子数相等
B. 等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等
C. 10g 2H216O和10g 1H218O的物质的量不相等
D. 氧元素的相对原子质量等于一个氧原子的质量与一个12C原子质量的十二分之一相比所得数值。
|
|
编号 |
实验 |
操作 |
|
A |
取出分液漏斗中所需的上层液体 |
下层液体从分液漏斗下端管口放出,关闭活塞,上层液体从分液漏斗上口倒出 |
|
B |
配制一定浓度的氯化钾溶液1000mL |
准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
|
C |
鉴别NaCl溶液和KCl溶液 |
用焰色反应 |
|
D |
FeCl2是否已被氧化而变质 |
用KSCN溶液检验 |
8.日常生活中常用到化学知识,下列说法正确的是
A.赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色
B.聚乙烯塑料有毒,不可用于制食品包装袋
C.明矾溶于水生成的Al(OH)3胶体,可除去水中的悬浮颗粒等杂质
D.某雨水样品放置一段时间后pH由4.68变为4.28,是因为水中溶解的CO2增多
7.下列化学式表示的物质一定是纯净物的是 ( )
A. C2H4 B. C2H4Cl2 C. C6H6 D. C5H10
21A.《物质结构与性质》模块(12分)
二茂铁[(C5H5)2 Fe]是由一个二价铁离子和2个环戊烯基负离子构成,它的发现可以说是有机金属化合物研究中具有里程碑意义的事件,它开辟了金属有机化合物研究的新领域,促进了金属有机化学的发展。二茂铁可以用还原铁粉与环戊二烯在氮气氛围中发生反应而制得:
2C5H6+Fe(还原铁粉)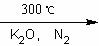 (C5H5)2
Fe+H2。
(C5H5)2
Fe+H2。
请回答下列问题:
(1)写出二价铁离子的基态电子排布式: ;
(2)二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂。据此可推断二茂铁晶体为 晶体,由此可进一步推知,在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是 ;
(3)环戊二烯的结构式为: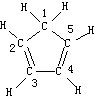 (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),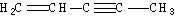 是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有
是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有
个;
(4)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与N2分子互为等电子体的二价阴离子是 (填化学式),其电子式是 。
21B.《实验化学》模块(12分)
某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,在教师指导下设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应生成沉淀的离子),Cl―即被全部沉淀。然后用含Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。请回答下列问题:
(1)滴定反应达到终点的现象是: 。
(2)实施滴定的溶液以呈 (选填“酸性”、“中性”或“碱性”)为佳,加入 (填化学式)试剂可达这一目的。
(3)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n (Clˉ)的测定结果 (选填“偏高”、“偏低”或“无影响”)。
(4)到达终点后,则必须轻轻摇动锥形瓶,(此时不得剧烈摇动)以减少误差,否则这种误差会使n (Clˉ)测定值偏低,这说明两者的溶解度:AgCl AgSCN
(填“>”或“<”=。
(5)若以Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3时,用去上述浓度的NH4SCN溶液20.0mL,则原氯化锶样品的纯度为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com