
12.下列叙述正确的是 ( )
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B.在常温下,10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)+ c(CH3COOH)= c(H+)+c(Na+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
11.在一定条件下,向密闭容器中按3︰2的体积比充入CO和水蒸气使其反应,
当CO+H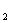 O(气)
O(气)  CO
CO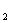 +H
+H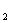 达到平衡时,水蒸气与H
达到平衡时,水蒸气与H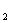 的体积分数相等,则下列叙述中,错误的是
( )
的体积分数相等,则下列叙述中,错误的是
( )
A.平衡时CO的体积分数为40%
B.平衡时CO的转化率为25%
C.平衡时水的转化率为50%
D.平衡时混合气体的平均相对分子质量为24
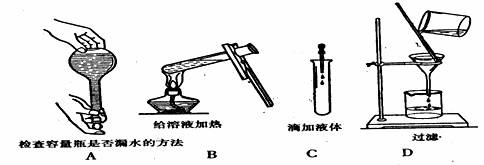
10.如图所示,下列实验操作与方法正确的是 ( )
9.下列三种有机物是某些药物中的有效成分
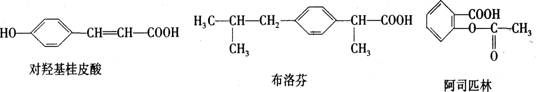
下列说法正确的是 ( )
A.三种有机物都是芳香烃
B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C.将等物质的量的三种物质加入NaOH溶液中,阿司匹林消耗NaOH最多
|
8.已知X、Y、Z三种主族元素在周期表中的相对位置如图所示,且X的原子序数为a,下列说法不正确的是 ( )
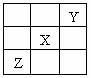
A.Y、Z的原子序数之和可能为2a
B.Y的原子序数可能是a-17
C.Z的原子序数可能是a+31
D.X、Y、Z一定都是短周期元素
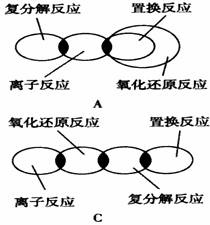
7.离子反应、复分解反应、置换反应和氧化还原反应之间可用下列集合关系表示,其中正确的是 ( )
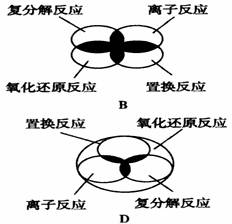
6.下列说法中正确的是 ( )
①煤的液化为物理变化
②乙醇、苯甲醇、甘油同属于醇类
③棉花、羊毛、蚕丝都属于纤维素
④葡萄糖能发生银镜反应和水解反应
⑤含氮、磷化合物的生活污水大量排放可使水体富营养化
⑥各国工业大量排放二氧化硫是全球气候变暖的主要原因
⑦石油分馏的目的之一是获得轻质燃料油(尤其是汽油)
A.除⑥外 B.全部正确 C.①④⑤ D.②⑤⑦
29.(l6分)
存在如下图所示转化关系。
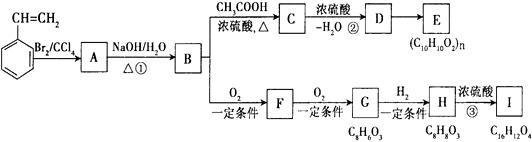
请回答下列问题:
(1)反应①、②的反应类型分别是 、 。
(2)C可能的结构简式有 。
(3)H有多种同分异构体。符合下列条件的同分异构体共有 种。
①与FeCl 溶液发生显色反应;
溶液发生显色反应;
②lmolH最多能与3molNaOH反应;
③苯环上只有两个取代基。
其中,任意一种同分异构体的结构简式为 。
(4)反应③的化学方程式是 。
(5)聚苯乙烯可用于制备高频绝缘材料。由苯乙烯合成这种高聚物的化学方程式为
。
28.(18分)某研究性学习小组欲测定某绿色粉末Cu2(OH)2CO3·xH2O中的x值,并进行相关实验探究。
已知:Cu2(OH)2CO3·xH2O固体在加热条件下发生反应:
Cu2(OH)2CO3·xH2O 2CuO+CO2↑+(x+1)H2O
2CuO+CO2↑+(x+1)H2O
(Mr[Cu2(OH)2CO3])=222; Mr(CuO)=80; Mr(CO2)=44; Mr(H2O)=18)
[实验一]测定Cu2(OH)2CO3·xH2O中的x值
(1)准确称取m g。该粉末样品,置于批涡中,用酒精灯缓慢加热至完全分解,冷却,称得剩余固体的质量为m
g。该粉末样品,置于批涡中,用酒精灯缓慢加热至完全分解,冷却,称得剩余固体的质量为m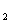 g。加热粉末时,除了坩祸、坩锅钳、三角架、玻璃棒、酒精灯外还要用到的仪器是 ,操作中需要用玻璃棒轻轻搅拌固体,目的是
g。加热粉末时,除了坩祸、坩锅钳、三角架、玻璃棒、酒精灯外还要用到的仪器是 ,操作中需要用玻璃棒轻轻搅拌固体,目的是
所测得的x值为_ (用含m 、m
、m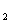 的代数式表示)。
的代数式表示)。
(2)下列是甲、乙两位同学对实验过程中绿色粉末是否已完全分解的判断依据。
甲:观察到粉末变成黑色,不再有水蒸气逸出。
乙:重复加热、冷却、称量,至恒重(两次称量的质量差不超过0.1g)。
你认为其中合理的是 (填“甲”或“乙”)。
(3)测定x值还有其它方法。下列是几位同学在实验设计中拟测定的数据,其中无法计算得出x值的是 (填序号)。
①只测定生成物CO2、CuO的质量
②只测定生成物CO2、H2O的质量
③只测定反应物Cu2(OH)2CO3·xH2O和生成物CO2的质量
④只测定反应物Cu2(OH)2CO3·xH2O和生成物H2O的质量
「实验二」利用上述反应的分解产物氧化铜氧化乙醇制备乙醛(沸点为20.8℃)。
(1)用如图所示装置(图中夹持装置已略去)进行实验时,需要加热的仪器是 (填标号)。B装置中收集到的物质有 。

(2)能证明氧化铜氧化乙醇的实验现象是
试管A内发生反应的化学方程式为 。
27.(14分)中学常见物质A、B、D、E、G、M、Q之间有如下图所示变化关系(反应条件已省略):
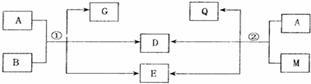
(1)若A是黑色非金属固体单质,G、Q、D是气体,E是水,D的化学式为 。
(2)若A是红色金属,B、M是同种溶质不同浓度的溶液,G、Q是气体,且G可通过化合反应生成Q。反应①的离子方程式是 。
(3)若A是Ca(OH)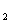 ,D是极易溶于水的气体。
,D是极易溶于水的气体。
①工业上合成D使用铁触媒作催化剂,采用500℃左右、20MPa-50MPa为生产条件的原因有 (填标号)。
a.化学反应速率最大 b.催化剂的活性最大
c.反应物转化率最大 d.综合经济效益较好
上述反应中,每生成lmolD时放出热量46.2kJ,该反应的热化学方程式是:
②当lmolCa(OH)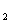 分别与B、m完全反应时,反应①、②生成的D的物质的量之比为2:1,B、M的化学式分别为 、 。
分别与B、m完全反应时,反应①、②生成的D的物质的量之比为2:1,B、M的化学式分别为 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com