
29.2008年北京奥运吉祥物福娃外用材料为纯羊毛线,内充物为无毒的聚酯纤维
( )。某同学甲设计了下列合成该聚酯纤维的路线图。
)。某同学甲设计了下列合成该聚酯纤维的路线图。
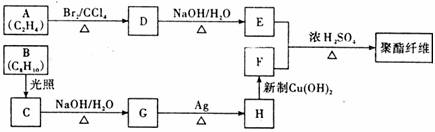
(1)下列说法正确的是____________。
A.羊毛线与聚酯纤维的化学成分不同
B. 聚酯纤维和羊毛在一定条件下均能发生水解
C. 聚酯纤维和羊毛都是可燃物
D. 该聚酯纤维的单体为对苯二甲酸和乙二醇
(2)B的结构简式为__________________________。
(3)写出下列反应的方程式
D→E: ___________________________________________________________
H→F:___________________________________________________________
(4)指出下列反应的反应类型:
A→D:_____________________ G→H: _______________________
(5)由G→H可能得到一种含量较多的副产物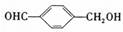 ,该副产物的同分异构体有多种,其中满足下列条件的还有_______种。
,该副产物的同分异构体有多种,其中满足下列条件的还有_______种。
①结构中含苯环 ②苯环上有两个取代基,有取代基通过碳原子与苯环相连
(6)同学乙认为该路线图复杂,可由B直接得到F。你的看法如何?______(填“可行”或“不可行”)如果可行,指出需要使用的试剂;如果不可行,说明理由。
28.现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
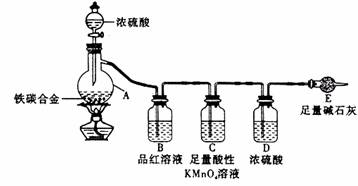
Ⅰ 探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
(2)将a g铁碳合金样品放入A中,再加入适量的浓硫酸。仪器A的名称为____________。
末点燃酒精灯前,A、B均无明显现象,其原因是:_________________________。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中发生反应的化学方程式_____________________________________(只写一个)。B中的现象是______________,由此可得到浓硫酸的具有____________性。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式_____
______________________(只写一个)。
(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_____________________________________。
Ⅱ 测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。铁碳合金中铁的质量分数为________________(写表达式)。
(7)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速准确的计算出铁的质量分数,最简便的实验操作是_____(填写代号)。
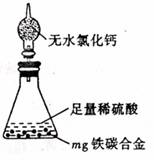
A. 用排水法测定H2的体积
B. 反应结束后,过滤、洗涤、干燥、称量残渣的质量
C. 测定反应前后装置和药品的总质量。
27.下列转化关系中的A~K均为中学化学中的常见物质,已知A是由两种元素组成的气态化合物,B是非金属单质,C是一种液态化合物。F的相对分子质量比D大16。(部分反应物、部分生成物和反应条件未列出)
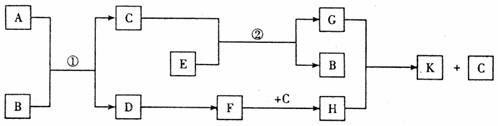
(1)若A为碱性气体(设为X),则A分子的空间构型为__________________,反应①的化学方程式为_______________________________________________;
(2)若A为酸性气体(设为Y),写出反应②的离子方程:_______ ____________________;
(3)若A是相对分子质量最小的气态化合物(设为Z),则A是_____________(填“极性”或“非极性”)分子,写出反应①的化学方程式_____________________________。
(4)上述X、Y、Z三种化合物在水中的溶解性由强到弱的顺序是___________________(用化学式表示)。
26.A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中:
①B、C同周期且相邻,D、E同周期,A与B、D不同周期;
②B、C、E三种元素的原子序数之和为32,C是地壳中含量最高的元素;
③D原子的电子层数等于其最外层的电子数。请回答:
(1)E元素是_________
(2)C与A形成的一种化合物的电子式为_______________;
(3)A、B、C三种元素形成的一种离子化合物的化学式为_____________________;
(4)D2C3的熔点A2C的熔点______________(填“高”或“低”),其原因是_____________;
(5)D与AE的水溶液反应的离子方程式为________________________________;
(6)写出C3的一种用途:__________________________________。
13.在托盘天平的左右的两托盘中各放置一只烧杯,调节天平使之平衡,向烧杯中分别注入足量且等质量、等浓度的稀硫酸,然后向两只烧杯中分别加入相同质量的锌片和铁银合金,反应完成后,天平仍保持平衡。合金中铁和银的质量比为 ( )
A.65:56 B.56:108 C.56:9 D.65:9
第Ⅱ卷(本卷共10题,共174分)
12.在25℃时将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,下列关系式正确的 ( )
A.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B. c(H+)= c(CH3COO-)+ c(OH-)
C. c(Na+)= c(CH3COO-)+c(CH3COOH)
D. c(Na+)>c(CH3COO-)> c(OH-)> c(H+)
11.某温度下,在容积固定的密闭容器中发生可逆反应A(g)+2B (g)  2Q(g),平衡时,各物质的浓度比为c(A):c(B):c(Q)=1:1:2,保持温度不变,以1:1:2的体积比再充入A、B、Q,则下列叙述正确的是 ( )
2Q(g),平衡时,各物质的浓度比为c(A):c(B):c(Q)=1:1:2,保持温度不变,以1:1:2的体积比再充入A、B、Q,则下列叙述正确的是 ( )
A.刚充入时反应速率v(正)减小,v(逆)增大
B.达到新的平衡时,反应混合物中,A、B的体积分数增加
C.达到新的平衡时c(A):c(B):c(Q)仍为1:1:2
D.达到新的平衡过程中,体系压强先增大,后逐渐减小,但新平衡压强比原压强大
9.高铁酸钠(Na2FeO4)是一种新型净水剂,可以对饮用水进行消毒和净化。工业上常通过如下方法制取:3NaNO3+Fe2O3+4NaOH==2Na2FeO4+3NaNO2+2H2O,下列有关说法正确的是 ( )
A. Fe2O3是氧化剂
B. Na2FeO4既是氧化产物又是还原产物
C.生成1mol Na2FeO4时,有3mol电子转移
D. Na2FeO4能净水是因为Na2FeO4中Fe3+水解生成Fe(OH)3胶体的缘故
|
A.醋酸钡溶液和硫酸反应:Ba2++SO42-====BaSO4↓
B.氢氧化钡溶液与碳酸氢铵溶液等体积、等物质的量浓度混合:
Ba2++2OH-+NH4++HCO3-=====BaCO3↓+NH3+H2O+H2O
C.硫化钠溶液显碱性:S2-+2H2O H2S+2OH-
H2S+2OH-
D.醋酸与碳酸钙发生反应:2CH3COOH+CaCO3====(CH3COO)2Ca+H2O+CO2↑
8.下列说法正确的是 ( )
A.分子晶体中一定含有共价键
B.干冰升华时分子内共价键会发生断裂
C.含有阴离子的化合物不一定含有阳离子
D.金属元素和非金属元素形成的化合物不一定是离子化合物
7.NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1mol氯气参加氧化还原反应,转移的电子数一定为2NA
B.标准状况下,密度为d g/L的某气体纯净物一个分子的质量为g
C.0.1molNa2O2与水反应转移电子数为0.2NA
D.25℃时,1L纯水中含有10-7NA个阴阳离子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com