
12.下列说法正确的是 ( )
A.相同条件下等质量的正丁烷燃烧放出的热量大于异丁烷,则可推知正丁烷的稳定性大于异丁烷
B.乙酸乙酯中混有乙酸,可选用无水乙醇和浓硫酸加热除去乙酸
C.甲烷、乙酸、乙醇都能发生取代反应
D.糖类、油脂、蛋白质都属于高分子化合物
11.NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.标准状况下,22.4LCCl4中含有氯原子数目为4NA
B.7gCnH2n中含有的氢原子数目为NA
C.常温下,100mL 0.1mol/L醋酸溶液中含醋酸分子为0.01NA
D.一定条件下2mol二氧化硫和1mol氧气混合,反应时转移的电子数为4NA
10.亚氯酸钠(NaClO2)可用作漂白剂,在酸性溶液中生成HClO2而发生分解,分解的化学方程式为2HClO2=2ClO2↑+HClO+H2O,ClO2是广谱消毒剂。下列说法正确的是( )
|
B.上述反应中,ClO2是还原产物
C.上述反应中,1molHClO2分解转移2mol电子
D.HClO2是有机酸
9.下列化学用语表示正确的是 ( )
A.硫酸氢钾加热熔融的电离方程式 KHSO4=K++H++SO42-
B.NH4HCO3溶液与过量的NaOH溶液共热 NH+4+OH- NH3↑+H2O
NH3↑+H2O
C.钢铁发生吸氧腐蚀的正极反应式4OH--4e-=2H2O+O2↑
D.常温下,用惰性电极电解饱和的Na2CO3溶液2H2O 2H2↑+O2↑
2H2↑+O2↑
29.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对还原产物中氮元素的化合价越低。某同学取一定量铁、铝的合金与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入2mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:

(1)图中OC段没有沉淀生成,此阶段发生的反应的离子方程式为 。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 。
(3)在EF段,沉淀的物质的量减少,写出此阶段发生反应的化学方程式 。
(4)B与A的差值为 mol。
(5)B点对应沉淀的物质量为 mol,C点对应的氢氧化钠溶液的体积为 mL。
28.I(4分)下面是中学化学中常用的玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)
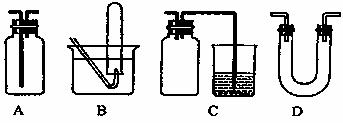
请回答下列问题:
(1)能用作干燥氨气的装置有 (填字母);
(2)既能用于收集氯气又能用于收集一氧化氮气体的装置有 (填字母);
(3)若用C装置作二氧化硫与烧杯中氢氧化钠溶液反应的实验,则其中广品瓶的作用是 。
Ⅱ(15分)某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题。
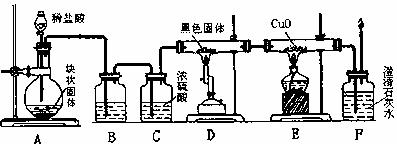
(1)写出装置A中所发生反应的离子方程式 。
(2)装置B中最适宜的试剂是 。
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是 。
(4)装置D中黑色固体为 (填名称)反应的化学方程式为 。
(5)按照如图装置进行实验时,首先进行的操作是 。
(6)根据实验中的 现象,可证明CO具有还原性,有关反应的化学方程式是 。
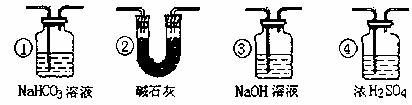
(7)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置 与 之间接下图中的 装置(填序号)
27.(19分)某有机物A(只含C、H、O)是一种重要化工生产的中间体,0.1mol有机物A在氧气中完全燃烧,生成39.6g CO2和9.0gH2O,试根据下列信息回答相关问题:
①A分子中碳原子总数是氧原子总数的3倍,其苯环上只有一个取代基,且取代基碳链上无支链;
②A在一定条件下可与乙酸发生酯化反应;
③A可与NaHCO3溶液作用,产生无色气泡。
请写出:
(1)A中含氧官能团的名称 A的分子式 。
(2)若有机物A在一定条件下可发生下列转换,其中A、E互为同分异构体,且都能与碳酸氢钠反应产生二氧化碳;F是含有三个六元环的化合物,K、I是酯化反应的产物。
提示:已知烯径在一定条件下可发生下列反应:
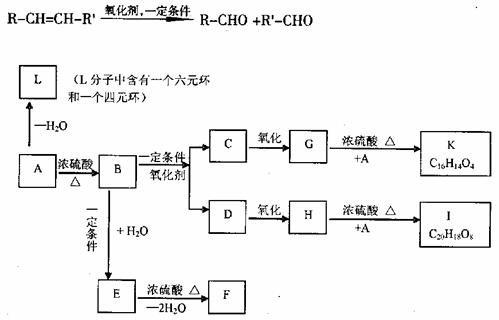
①写出A、B、C、E、F的结构简式:
A B C
E F
②写出H→I化学方程式 。
③写出A→L的化学方程式 ,反应类型 。
④A的一种同分异构体M,其苯环上有两个间位取代基,且能与三氯化铁溶液发生显色反应。M在稀硫酸存在下水解生成X和Y,其中Y是饮用假酒过程中致人失明、甚至残废的元凶。
请写出M的结构简式: 。
26.(14分)现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C可形成的化合物,常温下均为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题:
(1)写出下列是元素的符号D E 元素F在周期表中的位置 。
(2)甲是由A、C、D三种元素组成的一种常见化合物,是重要的工业产品,化合物甲的电子式为 , 生产F单质及此产品的工业称为 工业。
(3)B与F两种元素形成一种化合物分子,各原子确远达8电子结构,则该分子的结构式为 。
(4)为了除去化合物乙(A2EC4)稀溶液中混有的A2EC3,常采用A2C2为氧化剂,发生反应的离子方程式为 。
(5)A、B、C以原子个数比4:2:3所形成的化合物,晶体类型为 其水溶液的pH 7(填>、<或=),原因是 (用离子方程式表示)
(6)常温下,若0.1mol·L-1 50mL的甲溶液和0.06mol·L-1 50mL乙溶液混合,测得放出Q kJ的热量,此反应的热化学方程式为 。
13.下列叙述正确的是 ( )
①有单质参加的反应,一定是氧化还原反应
②镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更耐腐蚀
③用100mL的量筒量取21.48mL盐酸
④中和热的测定实验中,不能用金属丝(棒)代替环形搅拌玻璃棒
⑤用pH试纸测定硫酸溶液的pH为3.2
⑥配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分
A.①②④⑥ B.①③④⑤ C.③⑤⑥ D.②④
第Ⅱ卷(非选择题)
12.500mL NaNO3和Cu(NO3)2的混合溶液中c(NO3-)=4.0mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到11.2L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法不正确的是 ( )
A.原混合溶液中c(Na+)为2mol·L--1
B.上述电解过程中共转移1 mol 电子
C.电解得到的Cu的物质的量为0.5mol
D.电解后溶液中c(H+)为2mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com